2011年3月,日本发生9级地震,地震引发海啸及伤亡。灾区重建面临多种困难,其中饮水安全是重要问题之一。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
(1)高铁酸钾中铁元素的化合价为_______价,推测它具有的化学性质是____ __。
(2)在次氯酸钠(NaClO,84消毒液的主要成分)溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。发生的离子反应为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,氧化剂是________。将KOH加入到反应后的溶液搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为2KOH+Na2FeO4====K2FeO4+2NaOH。根据复分解反应原理,高铁酸钠的溶解度________高铁酸钾的溶解度(填“大于”、“小于”或“等于”)。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬)。有关离子方程式为FeO42-+CrO2-+2H2O====CrO42-+Fe(OH)3↓+OH-,2CrO42-+2H+====Cr2O72-+H2O,Cr2O72-+6Fe2++14H+====2Cr3++6Fe3++7H2O
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液30.00 mL。计算上述实验制得的样品中,高铁酸钾的质量分数为__________;
影响气体体积的因素是__ ____、__ ___。
物质的量是表示___________________的物理量,符号______,单位_______。
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下: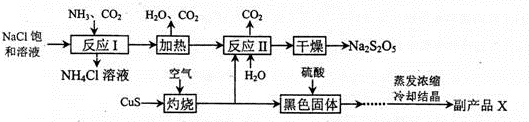
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作________________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L(标准状况下),则转移电子____ mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为_______________。
(4)副产品X的化学式是 ________________,在上述流程中可循环使用的物质是___________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂________________。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠
④酸性高锰酸钾 ⑤稀硫酸
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g)△H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。
2NH3(g)△H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。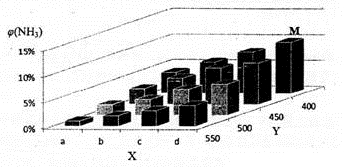
回答下列问题:
(1)已知: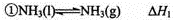 ,
, ,则反应N2(g)+3H2(g)
,则反应N2(g)+3H2(g) 2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
(2)合成氢的平衡常数表达式为____ ,平衡时,M点NH3的体积分数为10%,则N2的转化率为____ (保留两位有效数字)。
(3)X轴上a点的数值比b点 (填“大”或“小”)。上图中,Y轴表示 (填“温度”或“压强”),判断的理由是 。
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如下表所示: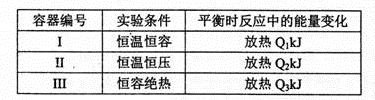
下列判断正确的是_____________。
| A.放出热量:Ql< Q2< △Hl | B.N2的转化率:I> III |
| C.平衡常数:II >I | D.达平衡时氨气的体积分数:I>II |
(5)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)______________c(SO42-)(填“>”、“<”或“=”)。
(6)利用氨气设计一种环保燃料电池,一极通入空气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_ _________。
某化学兴趣小组设计如下流程,从酸性工业废液(含H+、A13+、Mg2+、Cr3+、SO42-)中提取铬。
有关数据如下表:
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4·7H2O,酸性工业废液中加入适量氧化铝的作用是_ ___。
(2)若酸性废液中c(Mg2+)=0.lmol·L-l,为达到步骤①的实验目的,则废液的pH应保持在 范围(保留小数点后l位)。
(3)步骤②中生成NaCrO2的离子方程式为___ _ 。
(4)步骤④中反应的离子方程式为_____ 。
(5)步骤⑤在空气中充分灼烧的目的是 ,可选用的装置是__________(填序号)。
(6)用如图所示装置制取铬酸钠(Na2CrO4),回答相关问题。
①a是电源的_____________极,阳极的电极反应式为______________。
②若电解一段时间后阴极收集到标准状况下的气体3.36 L,则理论上可制得___________g铬酸钠(忽略反应2CrO42-(aq)+ 2H+(aq) Cr2O72-(aq)+ H2O(1)的影响)
Cr2O72-(aq)+ H2O(1)的影响)