两个体积相同的容器,一个盛有二氧化硫,一个盛有杂质为水蒸气的二氧化碳,在同温(120℃以上)同压(小于1个标准大气压)下,两容器内的气体一定相同的是
| A.质子总数 | B.质量 | C.密度 | D.原子总数 |
为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)的形式存在。已知在溶液中IO3-和I-发生反应:IO3-+5I-+6H+ 3I2+3H2O根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是
3I2+3H2O根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是
| A.①③ | B.③⑥ | C.②④⑥ | D.①②④⑤⑦ |
下列有关金属及其合金的说法不正确的是
| A.目前我国流通的硬币是由合金材料制造的 |
| B.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
| C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 |
| D.生铁、普通钢和不锈钢中的碳含量依次增加 |
“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得液体混合物
| A.有丁达尔现象 | B.一定是悬浊液 |
| C.一定能透过半透膜 | D.利用过滤的方法可分离出纳米材料 |
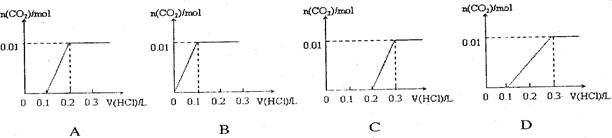
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是