(8分)2013年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分。综合治理其污染是环境化学当前的重要研究内容。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示: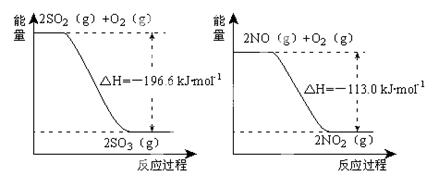
则NO2氧化SO2的热化学方程式为 _____________________________ 。
(2)SO2与O2反应时的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:
①压强:Pl P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充人体积为1 L的密闭容器中,经10min后测得容器中各物质的物质的量如下表所示:
| 气体 |
SO2 |
O2 |
SO3 |
| 物质的量(mol) |
1.6 |
1.8 |
0.4 |
10min内该反应的反应速率v(O2)= ;该反应达到化学平衡状态的标志是 。
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
(3)用NH3催化还原NOx可以消除氮氧化物的污染。
①写出氨气消除NO污染的化学方程式 ___________________________ ;
②若还原产物比氧化产物多0.5mol,则反应转移电子数为 ________ 。
锂钒氧化物电池的能量密度远远超过其它材料电池,其成本低,便于大量推广,且对环境无污染。电池总反应式为:V2O5+xLi=LixV2O5。下列说法中,不正确的是
| A.正极材料为锂,负极材料为V2O5 |
| B.向外供电时,锂离子在凝胶中向正极移动 |
| C.正极的电极反应式为:V2O5+xLi++xe-=LixV2O5 |
| D.负极的电极反应式为:xLi-xe-=xLi+ |
在其他条件不变的情况下,能使合成氨反应进行程度增大的方法是
| A.升高温度 | B.减小压强 | C.使用催化剂 | D.及时分离出氨气 |
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g),△H=+74.9kJ•mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
在铁制品上镀上一定厚度的铜,以下电镀方案中正确的是
| A.铜作阳极,铁制品作阴极,溶液中含Fe2+ |
| B.铜作阴极,铁制品作阳极,溶液中含Cu2+ |
| C.铜作阴极,铁制品作阳极,溶液中含Fe3+ |
| D.铜作阳极,铁制品作阴极,溶液中含Cu2+ |