某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
| A.Cl-一定存在,且c(Cl‑)≥0.4mol/L |
| B.至少存在5种离子 |
| C.SO42-、NH4+一定存在,Cl-可能不存在 |
| D.CO32-、Al3+一定不存在, K+可能存在 |
下列叙述中错误的是
| A.电解池是电能转化为化学能的装置 |
| B.原电池跟电解池链接后,电子从原电池负极流向电解池阳极 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.用惰性电极电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl- – 2e-=Cl2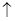 |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-= 4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu – 2e-= Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe – 2e- = Fe2+ |
电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是
| A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B.常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+) >c(CH3COO-) >c(H+)>c(OH-) |
| C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 |
| D.常温下,某溶液中有水电离出的c(H+)=10-51mol·L-1,则此溶液可能是盐酸 |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1mol/LHCOOH溶液中:c(HCOO-)+c(OH-) = c(H+) |
| B.1L0.1 mol/LCuSO4·(NH4)2SO4·6H2O的溶液中c(SO42->c(NH4+)>c(Cu2+)>c(H+)>c(OH-) |
| C.0.1mol/LNaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
下列溶液一定呈中性的是
| A.c(H+)=c(OH-)=10-6mol/L的溶液 |
| B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |