NA表示阿伏加德常数,下列说法正确的是
| A.2.24L HCl气体中含有0.1NA个HCl分子 |
| B.室温下,1molCH4含有的电子数为10NA |
| C.将0.1mol FeCl3溶于1L水中,所得溶液中含有0.1NA个Fe3+ |
| D.25℃时,1LpH=13的Ba(OH)2溶液中含有0.2NA个OH- |
下列各组分散系,按分散质粒子由大到小顺序排列的是()
| A.溶液、胶体、浊液 | B.胶体、浊液、溶液 |
| C.浊液、胶体、溶液 | D.浊液、溶液、胶体 |
实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是()
| A.8HCl+K2Cr2O7==2KCl+Cr2O3+4H2O+3Cl2↑ |
| B.16HCl+2KMnO4==2MnCl2+8H2O+2KCl+5Cl2↑ |
| C.4HCl+MnO2△MnCl2+2H2O+Cl2↑ |
| D.6HCl+KClO3==KCl+3H2O+3Cl2↑ |
下列反应一定是氧化还原反应的是( )
| A.化合反应 | B.分解反应 | C.复分解反应 | D.置换反应 |
下列关于液氯和氯水的叙述中正确的是( )
| A.液氯是纯净物,而氯水是混合物 | B.液氯无酸性,氯水有酸性 |
| C.液氯和氯水都有漂白性 | D.液氯无色,氯水呈黄绿色 |
下列反应中,水作还原剂的是( )
| A.2Na+2H2O==2NaOH+H2↑ | B.Cl2+H2O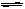 HCl+HClO HCl+HClO |
| C.2F2+2H2O==4HF+O2 | D.SO2+H2O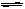 H2SO3 H2SO3 |