二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。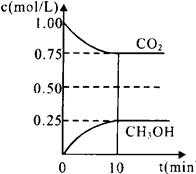
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使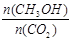 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。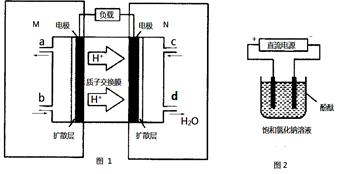
①M区发生反应的电极反应式为______________________ _________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
(氮化硅(
)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
+
+
 +
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
+
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是,其还原产物是;
(3)该反应的平衡常数表达式为
=;
(4)若知上述反应为放热反应,则其反应热Δ
零(填"大于""小于"或"等于");升高温度,其平衡常数值(填"增大""减小"或"不变");
(5)若使压强增大,则上述平衡向反应方向移动(填"正"或"逆");
(6)若已知
生成速率为
=18
·(
)-1,
则
消耗速率为
=
·(
)-1。
下图中的
均为有机物
据上图回答问题:
(1)
的化学名称是。
(2)反应③的化学方程式是:(有机物须用结构简式表示)
(3)
的分子式是:
的结构简式是反应的反应类型是
(4)符合下列3个条件的
的同分异构体的数目有个
ⅰ)含有邻二取代苯环结构、 ⅱ)与
有相同官能团、ⅲ)不与
溶液发生显色反应。
写出其中任意一个同分异构体的结构简式
(5)
是的工业原料,用化学方程式表示
的一种的工业用途
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉沉乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是。
(2)一定存在的离子是。
(3)判断沉淀乙成份的方法是。
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO 3 3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2 CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
| A.CO2+H2O +2NaClO===Na2CO3+2HClO |
| B.CO2+H2O +NaClO===NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH Na2CO3+2C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________(填数值);pH最大的是_________(填编号)。
①C6H5OH②CH3COOH③HCN④HClO⑤H 2SO4⑥HClO4
2SO4⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出N aCl晶体根据上述反应,总结出复分解反应发生的另一规律:___________________________________________;
aCl晶体根据上述反应,总结出复分解反应发生的另一规律:___________________________________________;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是_________________________,
请写出反应的离子方程式:______________________________________________。
在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化。
(1)先出现红色沉淀,原因是。
(2)随后沉淀溶解,溶液呈黄色,此反应的离子方程式是。
(3)最后溶液颜色加深,此反应的离子方程式是。
(4)若用稀盐酸代替HI稀溶液,能出现上述哪些相同的变化现象(填写上面各题序号)。