(10分)甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:
①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。回答:
(1)丁溶液是
(2)乙溶液的电离方程式
(3)丙溶液PH 7, 原因用方程式表示
(4)乙和丁反应的离子方程式
【原创】(10分)脱羧反应形成新的C-C键为有机合成提供了一条新的途径,例如: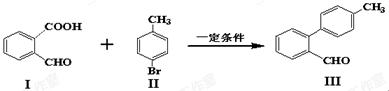
(1)化合物I含有的官能团名称是______________。
(2) 与
与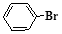 也能发生脱羧反应,有机产物的结构简式为 。
也能发生脱羧反应,有机产物的结构简式为 。
(3)化合物III与新制氢氧化铜反应的化学方程式为 。
(4)下列有关化合物Ⅲ的说法正确的是 。
| A.化合物无Ⅲ分子式为C14H15O |
| B.1mol化合物Ⅲ最多可以与6mol H2反应 |
| C.化合物无Ⅲ分子中的所有碳原子一定处于同一平面 |
| D.化合物Ⅲ既可以发生氧化反应和还原反应,也可以发生加成反应和取代反应 |
(5)写出符合下列条件的化合物的同分异构体 。
①化合物I的最简单同系物
②苯环上有两种不同类型的氢原子
(12分)为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1:2:3。
④用红外光谱仪处理该化合物,得到如图三所示图谱。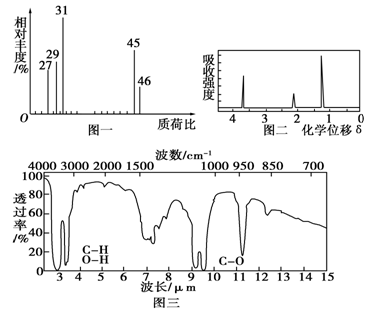
试回答下列问题:
(1)有机物A的相对分子质量是__________。
(2)有机物A的实验式是____________________。
(3)能否根据A的实验式确定A的分子式______(填“能”或“不能”),若能,则A的分子式是__________(若不能,则此空不填)。
(4)写出有机物A的结构简式______________。
【改编】卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多氯代甲烷常作为有机溶剂,其中分子结构为正四面体的是________。
(2)聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式为__________________________;
反应②的反应类型为________。
写出由氯乙烯制备聚氯乙烯的方程式_______________________。
0.2 mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2 mol。试回答:
(1)烃A的分子式为________。
(2)若取一定量的烃A完全燃烧后,生成B、C各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气________L。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为_____________________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为________________________;比烃A少2个碳原子的同系物有________种同分异构体。
【原创】请判断下列各组物质之间的关系(填“同位素、同素异形体、相同的物质、同系物或同分异构体”)
(1)1-已烯和环已烷 。
(2)新戊烷和2,2-二甲基丙烷_____。
(3) C和
C和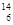 C 。
C 。
(4) 具有相同的通式。