(1)配平氧化还原反应方程式:
________C2O42-+________MnO4-+________H+===________CO2↑+________Mn2++________H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作______________(填“氧化剂”或“还原剂”),该滴定过程______________(填“需要”或“不需要”)另加指示剂。滴至16.00 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果______________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果____________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为____________,KHC2O4的质量分数为______________。
综合利用CO2、CO对构建低碳社会有重要意义。
(1)固体氧化物电解池(SOEC)用于高温电解CO2和H2O的混合气体,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。
①b为电源的 (填“正极”或“负极”)
②写出电极c发生的电极反应式 、 。
(2)电解生成的合成气在催化剂作用下发生如下反应:CO(g) +2H2(g) CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2mol CO和1mol H2,达到平衡时容器体积为2L,且含有0.4mol CH3OH(g),则该反应平衡常数值为 ,此时向容器中再通入0.35molCO气体,则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2mol CO和1mol H2,达到平衡时容器体积为2L,且含有0.4mol CH3OH(g),则该反应平衡常数值为 ,此时向容器中再通入0.35molCO气体,则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示: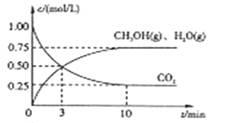
(1)从反应开始到平衡,氢气的平均反应速率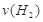 = mol/(L·min)
= mol/(L·min)
(2)该条件下CO2的转化率为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 |
| B.恒容时充入氮气 |
| C.将水蒸气从体系中分离 |
| D.用更有效的催化剂 |
Ⅱ.下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:[Ag:108]
(1)M极的电极材料为 。
(2)加入乙醇的铂电极的电极反应式为
(3)在此过程中乙池中某一电极析出金属银4.32g时,此时乙池溶液的体积为400mL,则乙池中溶液的pH为 。
(4)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出 29.71kJ热量,表示该反应的热化学方程式为 。
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子方程式表示)________________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是___________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是__________________________(请用反应的离子方程式表示)。
(4)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
(a)在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积D.c(OH-)
(b)NaA溶液显________(填“酸性”、“中性”或“碱性”),
将一定质量的镁、铝合金,投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:
(1)原合金中镁的质量为 ;
(2)盐酸的物质的量浓度为 。
(1)向200ml NaOH溶液中投入5.4gAl ,二者恰好完全反应,参加反应的NaOH的物质的量浓度 ,生成标况下氢气的体积____________
(2)从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4 + 5FeS2 + 12H2O ="=" 7Cu2S + 5FeSO4 + 12H2SO4
(已知FeS2中Fe显+2价)
还原剂是 (填化学式),Cu2S是 (选填“还原剂、氧化剂、还原产物、氧化产物或非氧化还原产物”),当有5 mol FeS2发生反应时,有 mol电子转移;
(3)在100 mL 0.5 mol/L AlCl3溶液中,加入100 mL NaOH溶液,得到1.56 g沉淀,NaOH溶液的物质的量浓度 。