随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示:
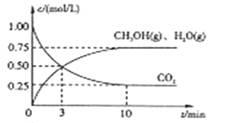
(1)从反应开始到平衡,氢气的平均反应速率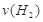 = mol/(L·min)
= mol/(L·min)
(2)该条件下CO2的转化率为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 |
| B.恒容时充入氮气 |
| C.将水蒸气从体系中分离 |
| D.用更有效的催化剂 |
Ⅱ.下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:[Ag:108]

(1)M极的电极材料为 。
(2)加入乙醇的铂电极的电极反应式为
(3)在此过程中乙池中某一电极析出金属银4.32g时,此时乙池 溶液的体积为400mL,则乙池中溶液的pH为 。
(4)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出 29.71kJ热量,表示该反应的热化学方程式为 。
某同学欲探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铁、铜反应的实验中的有关问题。
(1)在常温下,分别向盛有等量铁片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能观察到发生明显反应的是(填序号,下同),无明显反应现象的是。
(2)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能观察到随即发生剧烈反应的是,开始不反应,加热后发生反应的是,加热也不发生反应的是。能缓慢发生反应或微热时能发生反应的是,反应的离子方程式为: ;
先将铜与浓硫酸反应产生的气体X持续通入下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括。
a.通入X气体后先产生白色沉淀后溶解
b.通入X气体后溶液中无明显现象
c.通入Y气体后有沉淀产生
d.通入Y气体后沉淀溶解
e.通入Y气体后溶液中无明显现象
(3)若将(2)的Ba(OH)2换为氢硫酸,则通入X气体后的现象为,反应的化学方程式为。
(1)只用一种试剂即可除去少量杂质和鉴别物质。将其填在空格处。
| 编号 |
物质 |
试剂名称或化学式 |
| ① |
除杂质:NaHCO3溶液(Na2CO3) |
|
| ② |
除杂质:SiO2(CaCO3) |
|
| ③ |
除杂质:FeCl2溶液(FeCl3) |
|
| ④ |
鉴别:Na2CO3 Na2SiO3 Na2SO3溶液 |
|
| ⑤ |
鉴别:(NH4)2SO4 NH4C1 Na2SO4溶液 |
(2)氧化还原是常见的反应类型,根据信息回答以下问题: “四种基本反应类型与氧化还原反应的关系”也可用下图表达。其 中Ⅰ为化合反应,则Ⅱ为 反应。写出一个有水生成的符合反应类型Ⅲ的化学方程式:。写出一个有水参加的符合反应类型Ⅳ的化学方程式,其中水作为剂。(填氧化剂、还原剂等)
(3)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是。
氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
(1)a、b、c中反应的离子方程式为:。
e中的化学反应方程式为。上述反应中发生了氧化还原反应的是:(填“a”、“b”、“c”或“e”)。
(2)能证明氯水具有漂白性的现象是____________________________。
(3)久置的氯水变为________,用化学反应方程式表示为__________。
(4)实验室保存饱和氯水的方法是_____________________________。
铁和铁的化合物用途广泛。请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:_______________________。
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______________________________________。
(2)爱迪生蓄电池的反应式为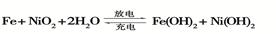
①爱迪生蓄电池的正极是,该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______。
②高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。写出在用电解法制取高铁酸钠时,阳极的电极反应式___________________________________。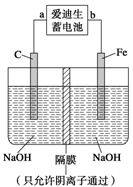
③你认为高铁酸钠作为一种新型净水剂的理由错误的是______。
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为___________。
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2(g)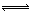 2NH3 (g) △H=" -" 92.4kJ/mol
2NH3 (g) △H=" -" 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为。
此温度下该反应的平衡常数K=。
②欲提高H2的转化率,下列措施可行的是。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)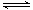 2NO2(g)△H<0体系中,各成分浓度随时间的变化如图:
2NO2(g)△H<0体系中,各成分浓度随时间的变化如图: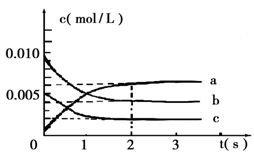
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是 _________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
4CO(g)+2NO2(g) 4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1
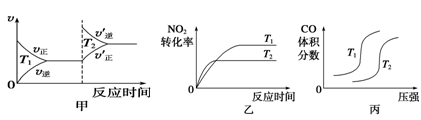
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。