CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关。
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2。
则MnO2在下述变化中的作用与NO2在上述过程中的作用相似的是 (填选项)
A.实验室用MnO2和浓盐酸混合加热制氯气
B.实验室用氯酸钾和MnO2混合加热制氧气
C.双氧水加入MnO2制氧气
D.高锰酸钾受热分解为二氧化锰、锰酸钾和氧气
(2)请写出用上述选项A实验室制氯气反应的离子方程式 ,若利用B和C制备等量的氧气,则转移的电子数目之比为 。
(3)很多现代化的纯碱厂,纯碱生产工艺仍沿用我国化学家侯德榜改进的纯碱生产工艺,其生产流程可简要表示如下:
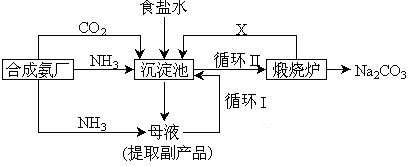
①上述生产纯碱的方法称侯德榜制碱法,沉淀池中发生的化学反应方程式是 。
②检验产品碳酸钠中是否含有氯化钠的操作方法为 。
③写出上述流程中X物质的分子式 ,副产品的一种用途为 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
钠放入到硫酸铜溶液中,现象是________,离子方程式为______。
在Fe、S2—、SO2、H+、Na+、S、Fe2+等物质或粒子中:
(1)只能被氧化,不能被还原的是;
(2)只能被还原,不能被氧化的是;
(3)既能被氧化,又能被还原的是。
在反应2F2+2H2O=4HF+O2中,作还原剂,元素被氧化;在反应Ca+2H2O=Ca(OH)2+H2↑中,作氧化剂,元素被还原。若在两个反应中,电子转移的物质的量相等时,产生氢气和氧气的质量比为。
已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多。A~H各物质的变化关系如下图所示。
(1)写出各步反应的化学方程式
反应①反应②
反应③反应④
反应⑤
(2)上述反应中属于氧化还原反应的有
氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
回答下列问题:
(1)10 min内以NH3表示的平均反应速率;
(2)在10 ~20 min内:NH3浓度变化的原因可能是;
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡的时间范围为:,第2次平衡的时间范围为:,
第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数;
(4)在反应进行至25 min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) + 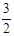 O2(g);△H =" a" kJ·mol—1
O2(g);△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a0;ΔS0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为: