(Ⅰ)地壳中含量第一金属元素构成的单质A与化合物B(相对分子质量为232)发生置换反应,产物为黑色固体C和另一单质D,单质D与水蒸气在高温下可得到B。则
(1)写出构成金属单质A的元素在周期表中的位置为 。
(2)写出D与水蒸气反应的化学方程式 。
(Ⅱ)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为_____________。
(4)为加快“酸浸”时的速率,可采取的措施有 、 等。(填两种即可)
(5)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得更多产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是____________________________。
烷基取代苯 可以被KMnO4的酸性溶液氧化生成
可以被KMnO4的酸性溶液氧化生成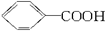 ,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被氧化得到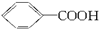 。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为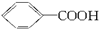 的异构体共有7种,其中的3种是
的异构体共有7种,其中的3种是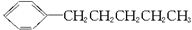 、
、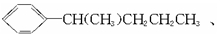
 ,请写出其他的4种结构简式:________________、__________________、________________、________________。
,请写出其他的4种结构简式:________________、__________________、________________、________________。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是 ;装置III中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5mol•L-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的化学方程式是 。
有机物A可作为合成降血脂药物安妥明(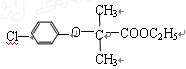 )
)
和某聚碳酸酯工程塑料(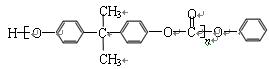 )的原料之一。
)的原料之一。
已知:
①如下有机物分子结构不稳定,会发生变化:
②某些醇或酚可以与碳酸酯反应生成聚碳酸酯,如:
相关的合成路线如下图所示。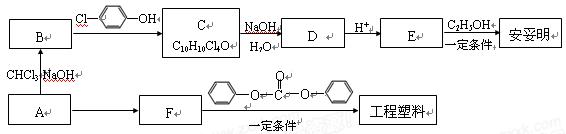
(1)经质谱测定,有机物A的相对分子质量为58,燃烧2.9 g有机物A,生成标准状况下3.36 L CO2和2.7 g H2O,A的核磁共振氢谱只出现一个吸收峰。则A的分子式是。
(2)E→安妥明反应的化学方程式是。
(3)C可能发生的反应类型(填选项序号) 。
。
a.取代反应b.加成反应c.消去反应d.还原反应
(4)F的结构简式是。
(5)写出同时符合下列条件的,E的同分异构体X的结构简式(只写1种即可)。
①X能与饱和溴水发生取代反应 ②X的苯环上有2个取代基,且苯环上的一溴取代物只有2种
②X的苯环上有2个取代基,且苯环上的一溴取代物只有2种
③1 mol X与足量NaHCO3溶液反应生成1 mol CO2,与足量Na反应生成1 mol H2
④X与NaOH水溶液发生取代反应所生成的官能团能被连续氧化为羧基
与淀粉相关的物质间转化关系如下图所示。其中B的分子中含有一个甲基,B与羧酸和醇均能发生酯化反应;C的催化氧化产物既是合成酚醛树脂的原料之一,又是常见的居室污染物;E能使Br2的CCl4溶液褪色。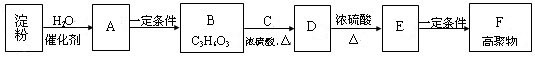
(1)B的结构简式是。
(2)E→F的化学方程式是。
(3)某同学欲验证淀粉完全水解的产物A,进行如下实验操作:①在试管中加入少量淀粉 ②加热3~4 min ③加入少量新制的Cu(OH)2悬浊液④加入少量稀硫酸⑤加热
⑥待冷却后,滴加NaOH溶液至溶液呈碱性。则以上操作步骤正确的顺序是(填选项序号)。
a.①②④⑤③⑥ b.①④②③⑤⑥ c.①④②⑥③⑤ d.①⑤③④⑥②
海水资源的利用具有非常广阔的前景。
(1)海水淡化的主要方法有(只写出1种即可)。
(2)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可以制备多种化工产品。
①用石墨电极电解饱和食盐水时,阳极的电极反应式是。
②常温下,用石墨电极电解饱和食盐水,当阴极产生的气体体积为112 mL(已折算为标准状况)时停止电解,此时溶液体积为1 L,若忽略气体的溶解,最终溶液的pH约为。