NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子方程式表示)________________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是___________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是__________________________(请用反应的离子方程式表示)。
(4)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
(a)在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(b)NaA溶液显________(填“酸性”、“中性”或“碱性”),
下面是印刷电路板的生产及其废液的处理的流程简图。请按要求填空: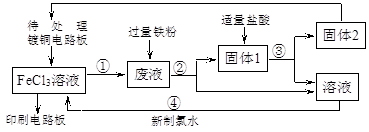
(1)镀铜电路版制成印刷电路版的离子方程式为;固体1的化学成分是(填化学式)。
(2)反应①的化学方程式为;要检验废液中是否含有Fe3+所需的试剂是(填化学式)溶液。
(3)反应④的离子方程式为。
已知氧化还原反应与四种基本反应类型的关系可用如图表示,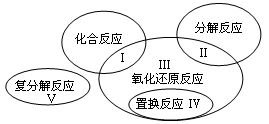
下列是有水参加或生成的几种反应:
①CaO + H2O ==Ca(OH)2
②2Na + H2O ="=" 2NaOH + H2↑
③H2 + CuO 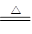 Cu +H2O
Cu +H2O
④3S+6NaOH 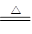 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH + HCl ="=" NaCl + H2O
请回答下列问题:
(1)反应①中水(填字母)。
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
(2)反应③被氧化的元素是(填元素符号)。
(3)上述反应中,属于区域Ⅲ的是 (填序号)。
(4)写出一种符合区域Ⅴ且既有沉淀生成又有水生成的离子方程式:。
请分别选用一种试剂除去下列物质中的杂质,并写出相应的离子方程式。
| 物质 |
杂质 |
所选试剂 |
离子方程式 |
|
| ① |
NaCl溶液 |
Na2CO3 |
||
| ② |
Mg粉 |
Al粉 |
按要求写出下列反应的化学方程式:
①将一小块钠投入水中:。
②氢氧化铝与氢氧化钠溶液反应:。
③过氧化钠与水反应:。
(1)CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施。
(2)水中含有的悬浮颗粒物等杂质,可以加入等混凝剂进行净化处理,利用其溶解后形成的______具有吸附作用使水中的悬浮颗粒物沉降。
(3)最近,国内第一个跨区域日处理垃圾1000吨以上的垃圾焚烧发电厂在江苏如皋投入使用。下面列出了现代生活中的常见垃圾:
| A.废纸 |
| B.废电池 |
| C.易拉罐 |
| D.玻璃瓶 |
E.塑料制品
在焚烧处理前,除废电池外,还有(填序号)应剔除并回收,随意丢弃电池会造成重金属离子污染的危害。