(1)化合物A含C、H、O三种元素,相对分子质量为60,其中碳和氢的质量分数分别是60%和13.3%。A在催化剂Cu的作用下被氧化成B,B能发生银镜反应,则A的结构简式是________ ________,B发生银镜反应的化学方程式__________________________________________
(12分)已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。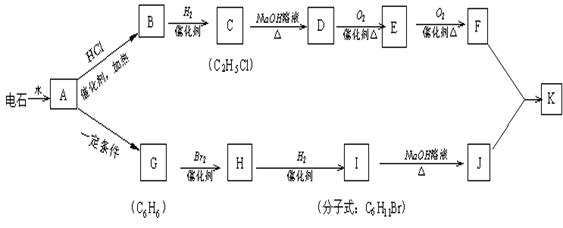
试回答下列:
(1)写出由G制取H的化学方程式:;
(2)写出C发生消去反应的化学方程式:;
(3)写出D→E的化学方程式:;
(4)B在一定条件下可合成一种重要的塑料,写出该合成反应的方程式:_________________;
(5)写出酯K的结构简式:;
(6)已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛,
如: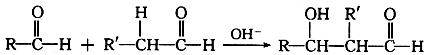
则乙醛在NaOH溶液作用下反应的化学方程式是:
烷基取代苯 可以被KMnO4酸性溶液氧化成
可以被KMnO4酸性溶液氧化成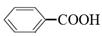 ,但若烷基R中直接与苯环相连的碳原子上没有C—H键,则不易被氧化得到
,但若烷基R中直接与苯环相连的碳原子上没有C—H键,则不易被氧化得到 。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成
。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成 的异构体共有7种,其中两种是
的异构体共有7种,其中两种是 、
、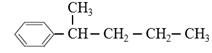 。
。
请写出其他5种的结构简式:_____________;______________;__________________;_____________;____________________。
写出下列反应的化学方程式,并指出反应类型:
(1)实验室制乙烯()
(2)用甲苯制备TNT()
(3)苯酚和浓溴水的反应()
(4)1,2-二溴乙烷与其足量氢氧化钠的乙醇溶液加热:( )
(5)乙醛与银氨溶液的反应()
某有机物A的结构简式为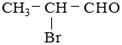 ,请回答下列问题。
,请回答下列问题。
(1)A中所含官能团的名称是、;
(2)A可能发生的反应有(填序号);
① 取代反应② 消去反应③ 水解反应④ 酯化反应
(3)将A与氢氧化钠的乙醇溶液混合并加热,再让得到的主要产物发生加聚反应,生成了某聚合物,该聚合物的结构简式是。
按要求回答下列问题。
(1)根据系统命名法,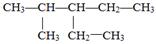 的名称是;
的名称是;
(2)羟基的电子式是;(3)顺-2-丁烯的结构简式是;
(4)相对分子质量为72且沸点最低的烷烃的结构简式;
(5)2,3-二甲基-2-戊烯的键线式;
(6)4,4,5-三甲基-2-己炔的结构简式.