一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍: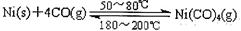 ,则该反应的△ H 0(选填“>”或“<”)。
,则该反应的△ H 0(选填“>”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
(4)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题: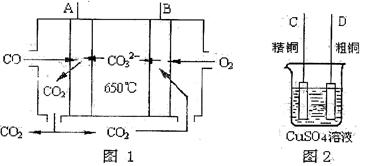
①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为 。
(本题共12分) 芳香烃都含有苯环,其中二个或二个以上的苯环共用相邻碳原子的叫“稠环芳烃”。
43.菲的分子式是C14H10,是一种稠环芳烃,结构如图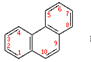 。它的一氯代物有种。
。它的一氯代物有种。
44.以下有机物分子式都为C13H12,且都含有两个苯环和一个侧链。
(1)其中不能使溴水褪色的有4种,其中一种为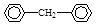 ,试再写出另一种的结构简式____________。
,试再写出另一种的结构简式____________。
(2)写出1种符合以下条件的物质的结构简式________________。
①属稠环芳烃②含有-CH2CH=CH2基团
45.写出将环己烯通入下列两种溶液后出现的现象。
(1)通入溴水:(2)通入溴的四氯化碳溶液:。
46.在苯和苯酚的溴化反应中,有三个方面可说明羟基对苯环取代反应的“活化”作用:
①苯要用铁为催化剂,而苯酚不须用催化剂;②;
③。
(本题共12分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。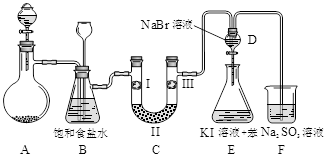
32.制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:。
33.装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象。
34.装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入。
| A |
B |
C |
D |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
35.设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为深棕红色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是。该现象说明溴的非金属性强于碘(填“能”或“不能”),原因是 .
(本题共10分)水煤气转化反应CO(g)+H2O(g)  CO2(g)+H2 (g)在一定温度下达到化学平衡。完成下列填空:
CO2(g)+H2 (g)在一定温度下达到化学平衡。完成下列填空:
29.写出该反应的平衡常数表达式K=________________。
30.一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是(选填编号)。
| A.容器中的压强不变 |
| B.1 mol H―H键断裂的同时断裂2 molH―O键 |
| C.v正(CO) = v逆(H2O) |
| D.c(CO) = c(H2) |
31.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验1和实验2的数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
3 |
| 2 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 3 |
950 |
1 |
2 |
— |
— |
— |
(1)由实验组1的数据可知,平衡时CO的转化率为%。
(2)由实验组1和2的数据可分析,压强对该可逆反应的影响是。
(3)有了实验组1和2的数据,再设计实验3,其目的是。
(本题共12分)氰酸(化学式:HOCN)是一种有挥发性和腐蚀性的液体,在水中立刻发生如下反应形成盐X(俗名碳铵):HOCN + 2H2O → X。
23.在上述反应所涉及的各元素中,半径最大的元素原子核外电子共占据_______个轨道。
24.能说明氮元素的非金属性比碳元素强的事实是_________(选填编号)。
A.共用电子对偏向:H-N>H-CB.氧化性:NO2>CO2
C.酸性:HNO3>H2CO3 D.沸点:NH3>CH4
25.据测定,氰酸有两种结构,一种分子内含有叁键,称为正氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出正氰酸和异氰酸的结构式:_______________、______________。
26.下面是工业上冶炼Cr时会涉及到的反应:
CrO42-+ S+ H2O → Cr(OH)3↓+S2O32-+
(1)请将方程式补充完整并配平。
(2)上述反应中,若转移了3mol电子,得到的还原产物是mol。
27.铁和镍(Ni)位于周期表的同一周期同一族,铁和镍在周期族。
28.镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150℃时,Ni(CO)4分解为Ni和CO。Ni(CO)4是晶体,Ni(CO)4易溶于下列(填序号)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(10+2分)硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
已知几种盐的溶解度随温度变化的曲线如图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品Ⅰ的化学反应方程式为;实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有。
(3)为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是,洗涤干燥。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,。