(10分)在一密闭容器中发生反应N2+3H2 2NH3.达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
2NH3.达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是 (填选项);
(2)t1 t2 t3时刻分别改变的一个条件是(填选项)
A 增大压强 B、减小压强 C.升高温度
D、降低温度 E、加催化剂 F、充人氮气
t1时刻 t3时刻 t4时刻
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项);
(4)如果在t6对刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化情况;
(5)一定条件下,合成氨反应达到平衡时,测得反应混合气中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为
目前世界上比较先进的电解制碱技术是离子交换法,如图为 阳离子交换膜法电解饱和食盐水的原理示意图。
阳离子交换膜法电解饱和食盐水的原理示意图。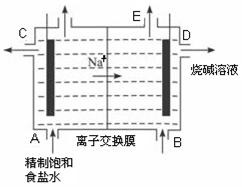
(1)下列说法不正确的是()
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D .粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),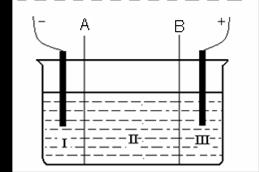
在这 种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。
种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。
A为离子交换膜、B为离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为,在III区得到。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
按图所示装置,以石墨为电极电解氯化铜溶液。
(1)阴极为(“A”或“B”),阴极电极反应式
(2)如要用电解的方法精炼铜,电解液选用CuSO4溶液,则阳极的材料是(填写“粗铜”或“纯铜”)
阳极电极反应式为(不写杂质 的)。
的)。
短周期主族元素A、B、C、D的原子序数依次增大,A与D同主族,B与C在同一周期,B原子最外层电子数比C原子少2个, A、C单质在常温下均为气体,它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质在常温下能剧烈反应生成A的单质。所得溶液滴入酚酞显红色。回答下列问题:
⑴写出元素符号A,B,C,D。
⑵写出B与C两种单质完全反应后所得生成物的电子式,该分子空间构型为。
⑶ C、D两种单质在点燃条件下形成的化合物的电子式,判断其中的化学键的类型。
⑷写出两种由A、B、C、D四种元素组成的化合物的化学式、。
(10分)填空:(填编号)
A.  Li Li  |
B. N N  |
C. Na Na |
D. M M g E. g E. Li F. Li F. C G.C60 H .CH3CH2COOH I.HO-CH2CH2-CHO J.金刚石 K. P4L.SiO2 M.NH4Cl C G.C60 H .CH3CH2COOH I.HO-CH2CH2-CHO J.金刚石 K. P4L.SiO2 M.NH4Cl |
(1)和互为同位素;
(2)中子数相等,但不是同一种元素的是和;
(3)和互为同素异形体, 和互为同分异构体。
和互为同分异构体。
(4)熔化时需要破坏共价键的是;晶体中既有离子键又有共价键的是。
﹙15分﹚已知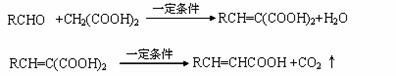
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)
A的相对分子质量是104,1molA与足量NaHCO3溶液反应生成2mol气体。
(1)A的结构简式是________________。
(2)在中学学过知识里 B不可能发生的反应是________ (填序号)
a、取代反应 b、加成反应c、氧化反应d、还原反应e、水解反应 f、显色反应
(3)等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是
( 4)写出C与足量的Na2CO3的化学方程式为:
4)写出C与足量的Na2CO3的化学方程式为:
(5)写出符合下列条件的阿魏酸的一种同分异构体的结构简式:。
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO 2气体;
2气体;
(6)写出利用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
___________________________________________________________________。