目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O。下列关于该电池的说法正确的是
| A.通入乙醇的电极为该电池的正极 |
| B.放电过程中,电源内部的H+从正极区向负极区迁移 |
| C.该电池的正极反应为:4H++O2+4e—=2H2O |
| D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。其中Y所处的周期序数与族序数相等。下列说法正确的是
| X |
|||
| Y |
Z |
W |
A.原子半径:Y<Z<W
B.气态氢化物的稳定性:X>Z
C.W的最高价氧化物与水反应形成的化合物是离子化合物
D.X的气态氢化物的水溶液能与Y的最高价氧化物对应水化物发生反应
设nA为阿伏伽德罗常数的数值,下列说法正确的是
| A.常温常压下,8gO2含有2nA个电子 |
| B.10L 0.1mol·L-1的氨水中有nA个NH4+ |
| C.标准状况下,22.4L盐酸含有nA个HCl分子 |
| D.1molNa与足量氧气反应生成Na2O和Na2O2的混合物,失去nA个电子 |
在水溶液中能大量共存的一组离子是
A.NH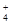 、Na+、Cl-、SO 、Na+、Cl-、SO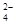 |
B.K+、Mg2+、OH-、NO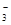 |
C.H+、Ca 2+、SiO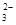 、NO3- 、NO3- |
D.K+、Al3+、ClO-、HCO3- |
下列说法正确的是
| A.聚酯纤维、有机玻璃、碳纤维都属于有机高分子材料 |
| B.蛋白质的水解产物都含有羧基和羟基 |
| C.曾在茂名轰动一时的PX(即对二甲苯)属于芳香烃,但不属于苯的同系物 |
| D.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
下述实验设计能够达到目的的是
| 选项 |
实验目的 |
实验设计 |
| A |
证明Ksp(AgCl)﹥Ksp(AgI) |
往AgCl悬浊液中滴入KI浓溶液 |
| B |
除去Cu粉中的CuO |
向混合物中滴加适量稀硝酸 |
| C |
检验溶液中是否含有Fe2+ |
向溶液中滴入KSCN溶液,再滴加氯水 |
| D |
证明H2CO3酸性比H2SiO3强 |
Na2CO3和SiO2在高温下熔融反应 |