下列各表述与示意图一致的是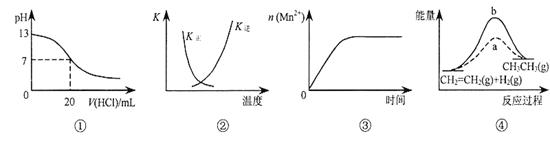
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g)+ O2(g) 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol•L-1的硫酸溶液:NH4+、Fe2+、Cl-、NO3- |
| B.pH=12的溶液K+、Na+、CH3COO-、Br- |
| C.与铝反应产生大量氢气的溶液: K+、NH4+、HCO3-、Cl- |
| D.酚酞呈红色的溶液:Na+、Fe2+、Cl-、SO42- |
下图是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是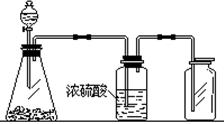
| A.碳酸钙和稀盐酸 | B.二氧化锰和浓盐酸 |
| C.锌粒和稀硫酸 | D.碱石灰和浓氨水 |
工业制取乙醇常用乙烯水合法:CH2 = CH2 + H2O CH3CH2OH。以下相关叙述错误的是
CH3CH2OH。以下相关叙述错误的是
| A.该反应属加成反应 | B.乙烯可以通过石油裂解获得 |
| C.乙醇官能团为羟基 | D.乙醇、乙醛和乙酸互为同系物 |
如图均为元素周期表短周期的一部分,其中b的氢化物和它的最高价氧化物对应的水化物能反应生成盐,下列有关a、b、c、d、e五种元素的叙述中,正确的是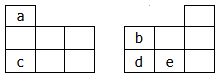
| A.原子半径:b > c |
| B.由a、b、e三种元素形成的化合物可能是离子化合物 |
| C.c与e以原子个数比2:1形成的化合物能促进水的电离 |
| D.氢化物的稳定性:b < d |
下列实验操作、现象和结论均正确的是
| 实验操作 |
现象 |
解释 |
|
| A |
常温下,用pH计测定NaHCO3溶液的pH |
pH=8.5 |
HCO3-的水解程度大于电离程度 |
| B |
向一定量的浓硫酸中加入过量的锌粒,微热至反应结束 |
产生气泡 |
该气体成分仅为SO2 |
| C |
往盛有少量水的两支试管中分别加入Na和Na2O2 |
固体溶解,产生气泡 |
两个反应中水都作氧化剂 |
| D |
往滴有KSCN的FeCl2溶液中通入少量Cl2 |
溶液由浅绿色变血红色 |
氧化性:Cl2> Fe3+ |