某化学反应 2A  B+D 在四个不同条件下进行.B、D起始为0.反应物A的浓度(mol/L)随反应时间(min)变化情况如下表:
B+D 在四个不同条件下进行.B、D起始为0.反应物A的浓度(mol/L)随反应时间(min)变化情况如下表:
| 实验序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.8 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据表中数据完成下列填空:
(1)实验1,反应在10至20min内的平均速率为 mol/(L.min)
(2)实验2,A的初始浓度C2 = mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1,且C3 1.0mol/L (填“<“,“>“或“=“).
(4)比较实验4和实验1,可推测该反应 反应(填“吸热“或”放热“),理由是:
石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有 结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由 聚合成的,其化学方程式是____________。
聚合成的,其化学方程式是____________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
利用海水可以提取溴和镁,提取过程如下。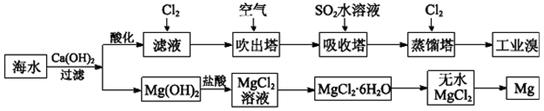
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是________,吸收塔中发生反应的离子方程式是__________。用平衡移动原理解释通空气的主要目的是_______。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是________________、过滤、洗涤、干燥。
(3)依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为________L(忽略Cl2的溶解)。
随着全球淡水资源危机日益严重,世界各国都把目光投向了占全球总水量约97%的汪洋大海,希望从苦涩的海水中提取可以饮用的淡水。
(1)海水淡化由来已久。二次大战时,一艘为盟军运送军事物资的商船遇难漂流到一座荒岛上。为了获取淡水,船员们将救生艇上的铜皮空气箱拆下,在空气箱上加盖一块边缘向内卷曲形成水槽的铜盖,做成一个简易蒸馏器。加热箱内的海水,水蒸气在盖顶冷凝后顺着边缘流进水槽。再滴入淡水桶内。根据上述文字的描述,为下图简易蒸馏器示意图补画铜盖。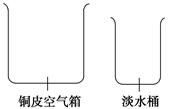
(2)海水淡化亦称海水脱盐。该工艺过程包括海水预处理、脱盐、淡化水的后处理等。下列属于海水预处理的是________(填序号)。
①淡水收集 ②除掉悬浮物 ③杀灭海洋生物 ④除掉海水中的盐分 ⑤水质检测 ⑥降低海水浑浊度
(3)为了检验所收集的淡水中是否含有氯离子,通常采用的试剂是_________。
溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。实验室模拟海水中溴的提取。
实验方法:将适量新制氯水加入到20 mL富含溴离子的海水中(海水可以用0.1 mol·L-1的NaBr溶液代替),把溴置换出来。氯水中的氯气作________________剂,涉及反应的离子方程式为__________________。
得到的单质溴可以用有机溶剂在________(仪器)中实现萃取富集,萃取试剂用________、苯等,得到的有机层显________色。
海水的综合利用可以制备金属镁,其流程如下图所示:
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。