(3分)
(1)硬水中含有可溶性钙、镁化合物中的“钙”、“镁”指的是__________ (填“元素”、“分子”、“原子”或“单质”)。
(2)下列做法可以降低水的硬度的是__________。(填番号)
A.吸附沉淀 B.过滤 C.活性炭吸附 D.蒸馏
E.投药消毒 F.煮沸
(3)已调平的天平左右两边分别放有两个相同质量的烧杯,分别装有质量相等的碳酸钠粉末和碳酸氢钠粉末,向两边烧杯中加入相同质量、相同溶质质量分数的稀盐酸。充分反应后,天平的偏向是__________。(填番号)
A.偏左 B.偏右 C.仍然平衡 D.不能确定
如图中A是碘元素在元素周期表中的信息,B﹣E是四种粒子的结构示意图。 请回答。

(1)碘的相对原子质量是 ; B是碘原子的结构示意图,碘离子的符号为 。
(2)B~E四种粒子中,属于同种元素的粒子是 (填字母,下同),化学性质相似的粒子是 。
用化学用语填空。
(1)2个氩原子 。
(2)汞元素 。
(3)3个二氧化硫分子 。
(4)醋酸 。
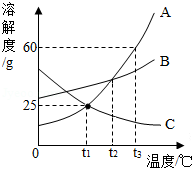
A、B、C三种物质的溶解度曲线如图所示,请回答下列问题:
(1)t2℃时,A、B、C三种物质溶解度的大小关系是 (用“A、B、C”和“>、<、=”表示)
(2)要使接近饱和的C溶液在保持溶质质量分数不变的情况下变成饱和溶液的方法是 。
(3)将100g质量分数为30%的A溶液由t3℃降温至t1℃,降温后所得溶液中溶质的质量分数是 。
(4)t3℃时,A、B、C三种物质的混合溶液中,A、B、C三种溶质的质量相等,将混合溶液在该温度下恒温蒸发溶剂,首先析出的物质是 。
联合国将2019年定为国际化学元素周期表年。下图是元素周期表中1~18号元素的原子结构示意图,请回答下列问题:

(1)原子序数为9的元素属于 (填“金属”或“非金属”)元素。
(2)具有相似化学性质的元素是 (填数字序号)。
①He、Mg ②O、S ③H、Na ④Cl、Ar
(3)元素M是第三周期中的一种元素,与氯元素形成的化合物的化学式为MCl3,则M的元素符号为 。
(4)同周期元素,随原子序数的增加,各元素的原子 依次增加
2019年“中国水周”的宣传主题为“坚持节水优先强化水资源管理”。
(1)天然水多为硬水,生活中可以通过 使其转化为软水
(2)活性炭能除去水中有颜色、有异味的物质,这是利用活性炭的 性
(3)右图是电解水的实验装置示意图。通电一段时间后,a管内产生的气体是 。
(4)坚持节约用水应从生活的点滴做起。请列举一种日常生活中节约用水的做法 。
