下列反应的离子方程式正确的是
| A.NaHSO3溶液中滴加过量的Ba(OH)2溶液:2HSO3-+2OH-+Ba2+ |
| B.硫化亚铁溶于稀硝酸中:FeS+2H+ |
| C.FeCl3溶液中滴加过量的氨水:Fe3++3NH3·H2O |
| D.向100mL3mol·L-1FeBr2溶液中通入标准状况下3.36LCl2:2Fe2++4Br-+3Cl2 |
下列哪种试剂可将NaCl、Na2CO3、(NH4)2SO4、NH4Cl四种溶液区分开( )
| A.AgNO3溶液 | B.BaCl2溶液 |
| C.Ba(OH)2溶液 | D.KOH溶液 |
在下列反应中,硫酸只表现出强氧化性的反应是()
| A.C与浓H2SO4反应 | B.Cu与浓H2SO4反应 |
| C.CuO与H2SO4反应 | D.Mg(OH)2与H2SO4反应 |
把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中NO3- —的物质的量浓度是(单位:mol·L—1) ( )
A. |
B. |
C. |
D.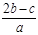 |
能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A.CO2溶于水形成碳酸,SiO2难溶于水 |
| B.CO2通入可溶性硅酸盐中析出硅酸沉淀 |
| C.高温下SiO2与碳酸盐反应生成CO2 |
| D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀 |
用一种试剂证明生石灰中含有石灰石和石英,下列试剂中最适宜的是( )
| A.盐酸 | B.硫酸 | C.NaOH溶液 | D.氯化钠溶液 |