用下列装置能达到预期目的的是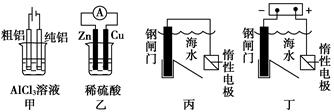
| A.甲图装置可用于电解精炼铝 |
| B.乙图装置可得到持续、稳定的电流 |
| C.丙图装置可达到保护钢闸门的目的 |
| D.丁图装置可达到保护钢闸门的目的 |
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患
者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10
下列推断正确的是()
| A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) |
| B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 |
| C.若误饮c(Ba2+)=1.0×10-5 mol/L的溶液时,会引起钡离子中毒 |
| D.可以用0.36 mol/L的Na2SO4溶液给钡离子中毒患者洗胃 |
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅
黄色沉淀。对上述过程,下列理解或解释中正确的是()
| A.Ksp(AgCl)<Ksp(AgBr) |
| B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀 |
| C.上述实验说明AgCl没有NaBr稳定 |
| D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解 |
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是()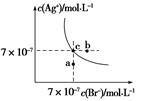
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是()
| A.CuS<Cu(OH)2<CuCO3 |
| B.CuS>Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS |
| D.Cu(OH)2<CuCO3<CuS |
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中
错误的是()
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11 mol·L-1 ×10-11 mol·L-1 |