海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘与溴一样易溶于有机溶剂):
(1)指出提取碘的过程中有关的实验操作名称:①________,③________。
(2)提取碘的过程中,可供选择的有机试剂是________。
A.苯 B.四氯化碳 C.酒精
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是 。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
① 。
② 。
③ 。
(5)进行上述蒸馏操作时使用水浴的原因是 。
(6)四氯化碳是____色液体。如果本实验用苯做萃取剂,则上层液体的颜色为 色,下层液体中溶质的主要成分为___________(写化学式)。
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境中会生成单质S。
Ⅰ制备Na2S2O3·5H2O反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)仪器a的名称是________,其作用是____________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是_________________。
Ⅱ测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O +2I-
+2I-
(3)滴定至终点时,溶液颜色的变化:________________________________。
(4)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
(5)如果滴定终点时俯视刻度线,所的结果 (填“偏大”“偏小”或“不变”)
Ⅲ.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为______________________________________ ______。
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |
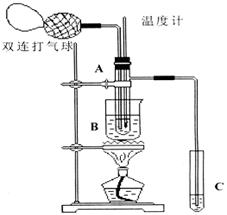
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是_____________________________;
(3)烧杯B的作用是___________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为_________________________________________。
为了分离甲醇、甲酸、苯、苯酚的混合物,有人设计了下列实验过程。请在括号内填写分离时所用操作方法,并写出方框内有关物质的结构简式。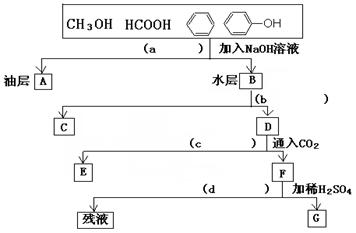
写出下列物质的结构简式A、C、
E、G。
现行中学教材中,有以下化学实验:
A.溴乙烷的水解
B.浓硫酸跟乙醇反应制乙烯
C.乙醛还原新制的氢氧化铜
D.乙酸乙酯的制取
E.石油的蒸馏
F.葡萄糖的银镜反应
G.乙酸乙酯的水解。
对以上实验,按下列各操作的要求,用字母A、B、C、——完成以下填空:(多填扣分)
(1)需用水浴加热的是;
(2)实验装置不需要检查气密性的是;
(3)为防止液体暴沸,常需加少量碎瓷片的是;
(4)需用温度计的是。
(11分)如图是某同学设计的放热反应的观察装置,其实验操作是: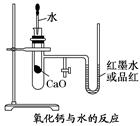
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液)打开T形管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹;
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,即可观察.
试回答:
(1)实验中观察到的现象是。
(2)该实验中必须进行的一步实验操作是。
(3)该实验的原理是。
(4)实验中发生的化学反应方程式:。
(5)说明CaO、H2O的能量与Ca(OH)2能量之间的关系:。
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象?(填“能”或“否”).