已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):
Cu+2H2SO4(浓)  CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)在参加反应的硫酸中,被还原的硫酸与未被还原的硫酸的物质的量之比为 。A物质可以与强碱反应生成盐和水。则A应该属于 (用字母代号填写)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)一定量的铜片与含1.8mol H2SO4的浓H2SO4充分反应(浓H2SO4过量),如果该反应过程中转移了0.2 mol电子,生成的CuSO4的质量为 g,生成的A气体在标准状况下体积为
L(假设气体全部逸出)。
(3)将(2)中反应后所得到的溶液稀释后与足量Ba(OH)2溶液反应,所得沉淀的质量为 g。写出此过程中发生反应的离子方程式:
,
。
(12分)饮用水消毒的主要目的是杀灭可引起霍乱、伤寒、痢疾等疾病的病菌,含氯消毒剂由于杀菌力 强,价格低等优点,一直是当今世界上应用最广泛的一种杀菌剂,为人类的健康立下了汗马功劳。回答下面各小题。
强,价格低等优点,一直是当今世界上应用最广泛的一种杀菌剂,为人类的健康立下了汗马功劳。回答下面各小题。
(1)氯气是一种色、具有刺激性气味、(填“无”或“有”)毒的气体。
(2)在水灾后,卫生防 疫部门向广大居民发放了漂粉精,用于饮用水的杀菌消毒,漂粉精的有效成分是。
疫部门向广大居民发放了漂粉精,用于饮用水的杀菌消毒,漂粉精的有效成分是。
(3)用化学方程式表示工业生产漂粉精的反应原理。
(4)已知H2CO3的酸性比HClO强,若把漂粉精暴露在空气中,请你推测会发生什么反应,写出反应的化学方程式,根据这一特性,漂粉精的保存方法为。
A能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。
① Ni原子的价电子排布式是__________。
② 该合金储氢后,含1mol La的合金可吸附H2的
物质的量为____________________。
(2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶 水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是____________________。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是__________。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8 电子稳定结构。
电子稳定结构。
该阴离子的电子式是__________,其中心原子N的杂化方式是__________。
草酸亚铁用作分析试剂及显影剂等,其制备流程如下: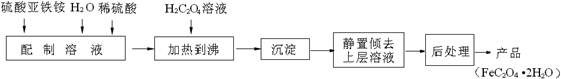
(1)配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是________________________________________________________。
6H2O溶液时,需加少量稀硫酸,目的是________________________________________________________。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图10(TG%表示残留固体质量占原样品总质量的百分数)。
①A B发生反应的化学方程式为
B发生反应的化学方程式为
__________________________________________。
C处时残留物的化学式为______________。
②有研究学者在实验过程中用气相色谱还检出
H2,最终产物中也有微量的磁性物质生成,_____________________________
请你猜想用一个方程式解释这种事实:______________________________ 。
③ 现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g) Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?____________________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?____________________________。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下: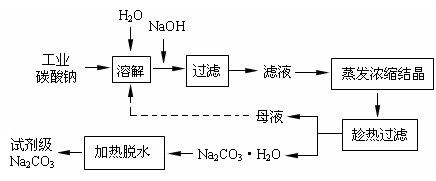
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
| Ksp |
4.96×10—9 |
6.82×10—6 |
4.68×10—6 |
5.61×10—12 |
2.64×10—39 |
回答下列问题: (1)加入NaOH溶液时发生的离子方程式为:_______________________________________;
(1)加入NaOH溶液时发生的离子方程式为:_______________________________________;
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8 时,c(M g2+):c(Fe3+)=__________________________。
g2+):c(Fe3+)=__________________________。
(2)“趁热过滤”时的温度应控制在_____________。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行很多次循环使用。请你分析实际工业生产中是否可行_____________,并说明理由:______________________________________________________________________________。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g)△H=+ 532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g)△H=+ 473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式_______________________________________。
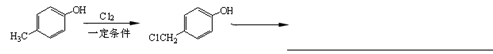
黄酮醋酸(F)具有独特抗癌活 性,它的合成路线如下:
性,它的合成路线如下:
已知:RCN在酸性条件下发生水解反应:

(1)写出A转化为B的化学方程式_________________________________。
(2)F分子中有3个含氧官能团,名称分别为羰基、___________和___________。
(3)E在酸性条件下水解的产物可通过缩聚反应生成高 分子化合物,该高分子化合物的结构简式为______________________。
分子化合物,该高分子化合物的结构简式为______________________。
(4)写出符合下列条件的D的两种同分异构体的结构简式______________________。
①分子中有4种化学环境不同的氢原子
②可发生水解反应,且一种水解产物能与FeCl3发生显色反应,另一种水解产物能发生银镜反应。
(5)对羟基苯乙酸乙酯( )是一种重要的医药中间体。写出以A和乙醇为主
)是一种重要的医药中间体。写出以A和乙醇为主 要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: