能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(来吸收合成气中的一氧化碳,其反虚原理为:
[Cu(NH3)2Ac](aq)+CO+NH3 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是 ;
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应b:CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①对于反应a,某温度下,将4.0 mol CO2(g)和12.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为 ;
②对于反应b,某温度下,将1.0mol CO(g)和2.0 mol H2(曲充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,温度和压强的关系判断正确的是 ;(填字母代号)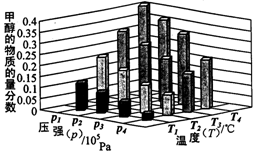
A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式 ;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式 。
本题为《化学反应原理(选修4)》模块选做题,每空2分,共20分。
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量。则表示H2燃烧热的热化学方程式是()
A.H2(g) +1/2 O2(g)=H2O(g)ΔH =+285.8 kJ/mol
B.H2(g) +1/2 O2(g)=H2O(l)ΔH =-285.8 kJ/mol
C.H2(g) +1/2 O2(g)=H2O(l)ΔH =+285.8 kJ/mol
D.H2 +1/2 O2 =H2OΔH =-285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是(填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ/mol
2NH3(g)ΔH=-92.4 kJ/mol
反应达到平衡后,升高温度则反应速率(填“增大”或“减小”);平衡将向(填“正反应方向”或“逆反应方向”)移动。
(2)锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
①该电池的负极材料是 ;电池工作时,阳离子向 (填“正极”或“负极”)移动;
②电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为ZnO+C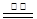 Zn+CO↑,此法属 (填选项字母代号)。
Zn+CO↑,此法属 (填选项字母代号)。
A.电解法 B.热还原法 C.热分解法
(3)今有常温下两种溶液:(A)0.1mol/L的NaCl溶液 (B)0.1mol/LNH4Cl溶液
①溶液(A)的pH 7(填“>”、“<”或“=”);
②溶液(B)呈性(填“酸”、“碱”或“中”),升高温度可以(填“促进”或“抑制”)NH4Cl的水解。
本题为《化学与生活(选修1)》模块选做题,每空2分,共20分。
人类的衣食住行都离不开化学,化学与生活密切相关。
(1)根据要求,选择恰当的选项用字母代号填空:
①“含氟牙膏”中的氟应理解为。
A.单质 B.元素 C.离子
②为适应低碳生活,上学或上班最好。
A.乘私家车 B.乘公交车
③糖类、油脂、蛋白质、无机盐、水、维生素是人类不可缺乏的营养物质。
下列维生素中,可用于防治坏血病的是。
A.维生素A B.维生素B1 C.维生素C
④抗生素药有阻止多种细菌生长的功能,下列药物属于抗生素药的是。
A.阿司匹林B.青霉素C.抗酸药(氢氧化铝)
⑤下列方法不属于目前常用的垃圾处理方法的是。
A.焚烧法 B.干馏法C.堆肥法
(2)在全球每年被腐蚀的钢铁中,电化学腐蚀比化学腐蚀所占比例(填“高”或“低”)。
(3)下表所列的一些物质都是家庭常用物质,请根据实验要求,选择合适的化学试剂,将其字母代号填入对应的空格中。
| 实验要求 |
化学试剂 |
供选择的化学试剂 |
| 检验味精中是否含有食盐 |
A.新制氢氧化铜悬浊液 B.硝酸银溶液和稀硝酸 C.碘水 D.碳酸钠粉末 |
|
| 检验地瓜粉中是否含有淀粉 |
||
| 检验食醋中是否含有乙酸 |
||
| 区别蔗糖和葡萄糖 |
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果(填“偏大”、“偏小”、或“不变”)。
(2)从石油中分离出汽油、煤油和柴油等,所采用的方法是__________(填“干馏”或“分馏”)。
(3)除去二氧化碳气体中的氯化氢杂质,选用的试剂是_________(填“NaOH溶液”或“饱和NaHCO3溶液”)。
(4)下图是实验室制取氨气的装置,回答下列问题:
①收集氨气的方法是排空气法。
②验证氨气是否收集满的方法是(写一种)。
下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
| 族 周期 |
ⅠA |
0 |
|||||||
| 1 |
H |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
⑤ |
Ne |
|||||||
| 3 |
① |
② |
③ |
④ |
⑥ |
(1)元素④的符号是;
(2)⑤和⑥两种元素原子半径的大小关系:⑤⑥(填“>”或“<”);
(3)①和②两种元素金属性强弱关系:①②(填“>”或“<”);
(4)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为: _ ________ _______。
硫及其部分化合物的转化关系如下图所示。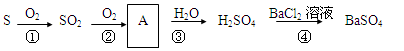
(1)SO2可以使品红溶液褪色,说明SO2具有(填“漂白性”或“氧化性”);
(2)化合物A的化学式为;
(3)反应④的离子方程式为。