高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从表格中判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++ SO42-
D.水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。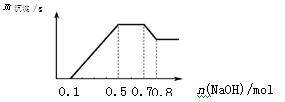
则下列说法正确的是
| A.溶液中的阳离子只有H+、Mg2+、Al3+ |
| B.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| C.溶液中n(NH4+)=0.2mol |
| D.n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1 |
下列说法正确的是
A.2NO2 N2O4-----①N2O4 N2O4-----①N2O4 2NO2--②,反应①的化学平衡常数是反应②的化学平衡常数的倒数 2NO2--②,反应①的化学平衡常数是反应②的化学平衡常数的倒数 |
| B.已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K101kPa条件下放热量为0.573kJ |
| C.已知298K 时,0.10mol/L HAc的电离度为1.32%。在0.10mol/L HAc和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化: HAc  H++Ac----①,NaAc=Na++Ac- ----②,Ac-+H2O H++Ac----①,NaAc=Na++Ac- ----②,Ac-+H2O HAc+OH- ----③,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定 HAc+OH- ----③,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定 |
| D.将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝 |
下列化学用语或物质的性质描述正确的是
A.右图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷 |
| B.符合分子式为C3H8O的醇有三种不同的结构 |
| C.乙烯在一定条件下能发生加成反应,加聚反应,被酸化高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸 |
D.治疗疟疾的青蒿素(如图) ,分子式是C15H20O5 ,分子式是C15H20O5 |
海洋电池,是以铝合金为电池负极,金属(Pt、Fe)网为正极,科学家把正极制成仿鱼鳃的网状结构。用海水为电解质溶液,它靠海水中的溶解氧与铝反应产生电能的。海水中只含有0.5%的溶解氧。不放入海洋时,铝极就不会在空气中被氧化,可以长期储存。用时,把电池放入海水中,便可供电, 电池设计使用周期可长达一年以上,避免经常交换电池的麻烦。即使更换,也只是换一块铝合金板,电池总反应式:4Al+3O2十6H2O=4Al(OH)3↓下列说法错误的是
| A.负极铝被氧化 |
| B.海水温度升高,电池反应速率可能加快 |
| C.正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积 |
| D.正极电极反应式为O2+4H+ +4e-=2H2O |
四种短周期元素W、X、Y、Z 的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子核的质子数之比为1:2,X和Y的电子数之差为4。下列说法正确的是
| A.原子半径大小:Z>Y>X>W |
| B.由W元素形成的单质一定是原子晶体,其熔沸点很高 |
| C.W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
| D.Y、Z所形成的氧化物的水化物的酸性为:Y<Z |