为确定某溶液的离子组成,进行如下实验:
①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的无色气体;白色沉淀部分溶解
③取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验,以下推测不正确的是
| A.一定有SO42- | B.一定有CO32- |
| C.不能确定Cl-是否存在 | D.不能确定SO42-是否存在 |
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如右图所示。下列判断不正确的是()
| A.曲线Ⅰ代表盐酸,曲线Ⅱ代表醋酸 |
| B.溶液中水的电离程度由大到小的顺序:a>b>c |
| C.溶液的导电性由强到弱的顺序:a>b>c |
| D.a点溶液中加入少量醋酸钠固体,溶液酸性降低 |
下列有关图像的分析正确的是()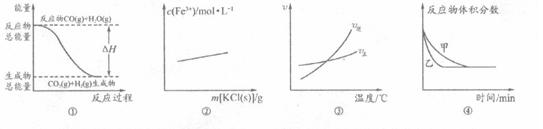
A.图①表示反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0 CO2(g)+H2(g)”中的△H大于0 |
B.图②可表示反应“3KSCN+FeCl3 Fe(SCN)3+3KCl”向正反应方向移动 Fe(SCN)3+3KCl”向正反应方向移动 |
C.图③表示反应“A2(g)+3Br(g) 2AB3(g)”的△H小于0 2AB3(g)”的△H小于0 |
D.图④可表示压强对反应“2A(g)+2B(g) 3C(g)+D(s)”的影响,且乙 3C(g)+D(s)”的影响,且乙 的压强大 的压强大 |
某燃料电池所用燃料为H2和空气,电解质为熔融的K2CO3。该电池的总反应为2H2+O22H2O,负极反应为H2+CO32――2e-H2O+CO2。下列说法正确的是()
| A.放电时CO32-向负极移动 |
| B.该电池正极反应式为:4OH――4e- |
| C.电池放电时,电池中CO32-数目逐渐减少 |
| D.电池放电时,电子经正极、负极、熔融的K2CO3后再回到正极,形成闭合回路 |
常温下,下列数据在比值为2:1的是()
A.0.2 mol/L的CH3COOH溶液与0.1 mol/ L的盐酸溶液中的c(H+)之比 L的盐酸溶液中的c(H+)之比 |
| B.pH=12的Ba(OH)2和pH=12的KOH溶液中溶质的物质的量之比 |
| C.Na2CO3溶液中:c(Na+)与c(CO32-)之比 |
| D.pH=7的氨水和(NH4)2SO4混合溶液中:c(NH4+)与c(SO42-)之比 |
下列说法或表示正确的是()
| A.将等质量硫蒸气和硫粉分别完全燃烧,前者放出热量多 |
B.由“C(石墨)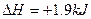 ·mol-1可知金刚石比石墨稳定 ·mol-1可知金刚石比石墨稳定 |
| C.稀的强酸和稀的强碱溶液反应的热化学方程式均为: H++OH- 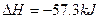 ·mol-1 ·mol-1 |
| D.在25℃、101 kPa时,1克氢气完全燃烧生成H2O放出热量142.9kJ。则: |
2H2O(1)2H2(g)+ O2(g);
O2(g);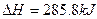 ·
· mol-1
mol-1