X、Y、Z、W有如右图所示的转化关系,且△H=△H1+△H2,则X、Y可能是( )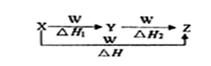
①C、CO ②S、SO2 ③AlCl3、Al(OH)3
④Na2CO3、NaHCO3 ⑤Fe、FeCl2
A.①②③④⑤ B.②④⑤ C.①③④ D.①②③
X、Y两种有机物的分子式不同,但均含有C、H或C、H、O,将X、Y以任意比例混合,只要物质的量之和不变,完全燃烧时所消耗的氧气量和生成水的物质的量也分别不变。则下列有关判断正确的是
A.X、Y分子式中氢原子数不一定要相同,碳原子数必定不同
B.若X为CH4,则相对分子质量最小的Y是甲醇
C.若X为CH4,则相对分子质量最小的Y是乙二醇
D.X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数)
25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃4L与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了9L,原混合烃中乙烷、乙炔和丙烯的体积比不可能为
| A.1:1:1 | B.2:1:1 | C.3:2:3 | D.5:3:4 |
已知苯与一卤代烷在催化剂作用下发生反应生成苯的同系物, 。在催化剂存在下,由苯和下列各组物质合成乙苯最好选用的是
。在催化剂存在下,由苯和下列各组物质合成乙苯最好选用的是
| A.CH3—CH3和Cl2 |
| B.CH2=CH2和Cl2 |
| C.CH2=CH2和HCl |
| D.CH3—CH3和HCl |
已知C—C键可以绕键轴自由旋转,结构简式为 的烃,下列说法中正确的是
的烃,下列说法中正确的是
| A.该烃苯环上的一氯取代物最多有4种 |
| B.分子中至少有11个碳原子处于同一平面上 |
| C.分子中至少有16个碳原子处于同一平面上 |
| D.该烃属于苯的同系物 |
下列说法正确的是
| A.分子式为CH4O和C2H6O的物质一定互为同系物 |
| B.甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| C.苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 |
D.1mol有机物 与足量的Na和NaOH完全反应,消耗的Na和NaOH物质的量之比为:3:2 与足量的Na和NaOH完全反应,消耗的Na和NaOH物质的量之比为:3:2 |