低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)该反应逆反应的化学平衡常数表达式为K = 。
(2)上述正反应方向是 反应(填“放热”或“吸热”)。
(3)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)= mol·L-1·min-1。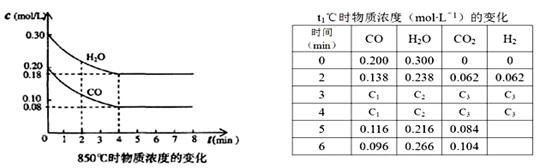
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3 min~4 min之间反应处于 状态;C1数值 0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是 (单选),表中5 min~6 min之间数值发生变化,可能的原因是 (单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为: 。
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是。
(2)500℃、50MPa时,在容积为VL的容器中加入nmolN2、3nmolH2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部
分物质的燃烧热数据如下表:
| 物质 |
燃烧热(kJ·mol-1) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1molH2O(g)转变为1molH2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式。
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)溴在周期表中位于_________周期,_________族。
(2)步骤④的离子方程式:________________________________________。
(3)步骤⑥的蒸馏过程中,溴出口温度为何要控制在80—90℃。温度过高或过低都不利于生产,请解释原因:___________________________________________。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是___________,分离时液溴从分离器的_________(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:。
A、B、C、D为短周期元素,请根据下表信息回答问题。
| 元素 |
A |
B |
C |
D |
| 性质或结构信息 |
工业上通过分离液态空气获得其单质,单质能助燃 |
气态氢化物显碱性 |
+3价阳离子的核外电子排布与氖原子相同 |
第三周期原子半径最小 |
(1)B在气态氢化物的电子式为: 。
(2)工业上电解法冶炼单质C的化学方程式为: 。
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质;D的单质与A的另一种氢化物反应生成A的单质。有关反应的化学方程式为:
; 。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是(填字母)。
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,写出该反应的离子
方程式为。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合
溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜平均溶解速率 (×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉
淀。制备CuCl的离子方程式是。
正长石是一种天然的硅酸盐矿,其组成可看作SiO2中部分Si原子被Al、K原子取代而成。当有25%的Si原子被Al原子取代(不足的价数由K原子补充)时,正长石的化学组成可表示为_______(填字母序号)。
| A.KAlSiO4 | B.KAlSi2O6 | C.KAlSi3O8 | D.KAlSi4O10 |
该正长石用二氧化硅和金属氧化物形式来表示,其组成为_____________________。