溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是 ,它是由 键形成的 分子。(填极性或非极性)
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为 ,
它的VSEPR模型是 ,分子构型是 。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。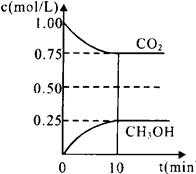
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使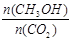 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件(填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。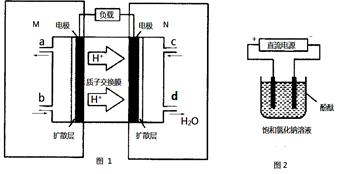
①M区发生反应的电极反应式为______________________ _________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为:。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
甲、乙两同学欲分别完成“钠与氯气反应”的实验。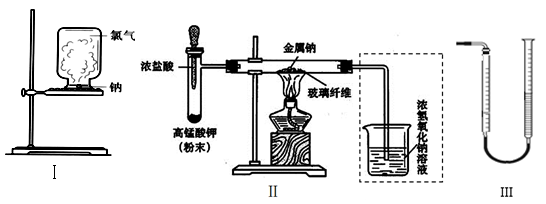
Ⅰ.甲同学的方案为:取一块绿豆大的金属钠(除去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶抽去玻璃片后倒扣在钠的上方(装置如图Ⅰ)。该方案的不足之处有。
Ⅱ.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为;待整套装置中后,点燃酒精灯。
(2)点燃酒精灯后,玻璃管中出现的现象是。
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积。
①为提高测量的准确性,图Ⅲ量气管装置中的液体可用;收集完气体后并读数,读数前应进行的操作是冷却至室温并。
②若未冷却至室温立即按上述操作读数,则会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)
③如果开始读数时操作正确,最后读数时俯视右边量气管液面,会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。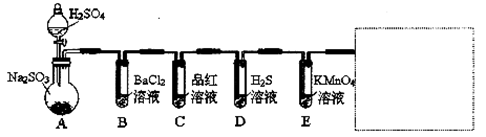
D中的实验现象是,C、E中溶液都褪色,分别体现SO2、性质。
(2)需在方框中画出装置,装置(只填写,不画图)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是,形成该沉淀的反应方程式有:。
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改进A装置(如图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是(填序号,不定项选择)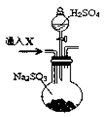
A.CO2B.NH3C.O3D.N2E.NO2
SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:①沉淀洗涤要干净,检验洗涤已经干净的实验操作是。
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示)。
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去) 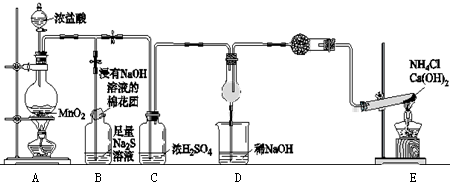
(1)写出A中反应的离子方程式。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式。
(3)试从原子结构角度解释氯的氧化性大于硫原因。
(4)D中干燥管中出现的现象及化学方程式;。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,该洗气装置中盛装试剂。
(6)还有什么方法能证明氧化性Cl2 > S,用一种相关事实说明。
(1)某一反应体系中有反应物和生成物共5种物质: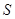 、
、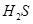 、
、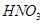 、
、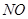 、
、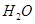 。则该反应中还原产物是______;若反应过程中转移了0.3
。则该反应中还原产物是______;若反应过程中转移了0.3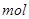 电子,则氧化产物的质量_____
电子,则氧化产物的质量_____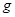 。
。
(2)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式。
①当 a / b =1时____________________________________________;
②当a / b≥3/2时____________________________________________。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3 +H2O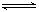 Al(OH)4― + H+;②NH3+H2O
Al(OH)4― + H+;②NH3+H2O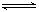 NH4++ OH―
NH4++ OH―
(A)已知B(OH)3是一元弱酸,试写出其电离方程式:__________________________;
(B)N2H4是二元弱碱,试写出其第二步电离方程式:_______________________________。