研究性学习小组用Na2SO3与硫酸溶液(硫酸与水体积比1∶1)制备SO2并进行性质探究实验。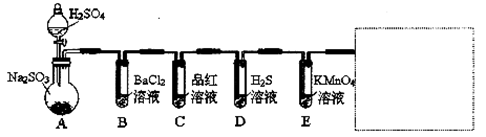
D中的实验现象是 ,C、E中溶液都褪色,分别体现SO2 、 性质。
(2)需在方框中画出 装置, 装置(只填写,不画图)。
(3)研究小组发现B中有白色沉淀,为了清楚沉淀的物质,研究小组往B中加入过量稀盐酸,沉淀不溶解,你认为留下的沉淀物是 ,形成该沉淀的反应方程式有: 。
为了进一步验证沉淀原因,研究小组另取BaC12溶液,加热煮沸,冷却及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改进A装置(如图),再进行实验,B中没有出现浑浊。下列气体可作为X气体的是 (填序号,不定项选择)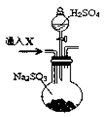
A.CO2 B.NH3 C.O3 D.N2 E.NO2
SO2为空气污染物,研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量溴水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g,则:①沉淀洗涤要干净,检验洗涤已经干净的实验操作是 。
②试计算此空气中SO2的浓度(列出计算表达式并计算结果,结果单位用mg/m3表示) 。
将H2O2慢慢加入到SbF5的HF溶液中得一白色固体A,A是一种盐类,其阴离子呈八面体结构。
⑴ A的结构简式,生成A的化学方程式。
⑵ A不稳定,能定量分解,B是产物之一,其中亦含有八面体结构,B的结构简式为。
⑶若将H2S气体通入SbF5的HF溶液中,则得晶体C,C中仍含有八面体结构,写出C的结构简式。生成C的化学反应方程式是。
⑷将H2O2滴入液氨中得白色固体D,D是一种盐,含有正四面体结构,写出D的结构式和生成反应方程式。
⑸比较H2O2和H2S的性质异同。
现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1、M2、M3,并依次增加14。经分析,相对分子质量为M2的酯,其中氧元素所占的质量分数为31.4%,并有三种酯的同分异构体。
请完成下列问题:
(1)相对分子质量为M2的酯的分子式为______________________________。
(2)饱和一元羧酸的分子式分别为______________________,______________________。
(3)参加反应的醇的结构简式为_______________、_______________、_______________、_______________(不必填满)。
(4)与相对分子质量为M1的酯互为同分异构体,能发生银镜反应,能与金属钠反应产生氢气的有机物的同分异构体有_______________种。
四川盛产五倍子。以五倍子为原料可制得化合物A。A的结构简式如下图所示: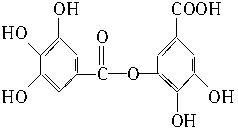
请完成下列各题:
(1)A的分子式是______________________________。
(2)有机化合物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式:___________________________________________________________________________。
(3)请写出A与过量NaOH溶液反应的化学方程式:______________________________。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看成是B与氢气按物质的量之比1∶2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式。
醛可以跟亚硫酸氢钠饱和溶液发生加成反应,生成物是水溶性的α羟基磺酸钠:
R—CHO+NaHSO3 RCH(OH)—SO3Na
RCH(OH)—SO3Na
反应是可逆的,在通常条件下有70%—90%向正方向转化。
(1)若氯苯中混有杂质苯甲醛,欲将此杂质全部除去,可采用试剂是_______________,其分离方法_____________________________________________________________________。
(2)若使CH3CH(OH)—SO3Na全部生成乙醛,可采用试剂是___________或_________,其分离方法是___________________________________________________________。
有四种无色液体:60%的酒精、福尔马林、甲酸和醋酸。只使用一种试剂M鉴别它们,其鉴别过程如下: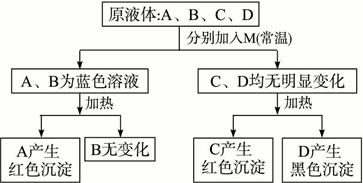
(1)试填写A—D所含有机物的结构简式。
A:______________,B:_______________,C:_______________,D:______________。
(2)试剂M的化学式:______________________________。