能正确表示下列反应的离子反应方程式为
| A.大理石溶于醋酸溶液: CaCO3 + 2H+==Ca2+ + CO2 ↑+ H2O |
| B.向FeBr2溶液中通入足量氯气:2Fe2+ + 4Br- + 3Cl2===2Fe3+ + 2Br2 + 6Cl- |
| C.NH4HCO3溶于过量的NaOH溶液中: HCO3- + OH-===CO32- + H2O |
| D.向明矾(KAl(SO4)2·12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3+ + 3SO42- + 3Ba2+ + 6OH-===2Al(OH)3↓ + 3BaSO4↓ |
ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,此过程说明ClO2具有(填“氧化”或“还原”)性。
(2)工业上可以通过下列方法制取ClO2,请完成该反应化学方程式:2KClO3+SO2=2C1O2+ 。
实验室欲配制100 mL、1mol/L的NaCl溶液,请回答:
(1)不需要使用的仪器是。
A、烧杯B、500 mL容量瓶C、量筒 D、胶头滴管 E、玻璃棒 F、100 mL容量瓶
(2)配制时用托盘天平应称取NaClg。
(3)配制溶液的操作顺序是(用字母表示) 。
A、称量 B、洗涤 C、定容 D、溶解 E、摇匀 F、转移
标准状况下,将充满O2和NO2混合气体的试管倒置于水中,液体完全充满试管。此时试管内溶液中溶质的物质的量浓度是
| A.0.045 mol/L | B.0.036 mol/L | C.0.026 mol/L | D.0.028 mol/L |
将8g铁片放入100 mL CuSO4溶液中,Cu2+全部被置换后,取出附有铜的铁片洗涤、干燥、称重,其质量变为8.2g,则原溶液中CuSO4的物质的量浓度是
| A.0.125ol/L | B.0.175mol/L | C.0.25 mol/L | D.0.5 mol/L |
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是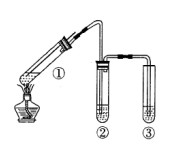
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |