根据已学知识,请你回答下列问题:
(1)试比较含氧酸的酸性强弱(填“>”、“<”或“=”): HClO3_____HClO4。
(2)根据价层电子对互斥理论判断:H2O的VSEPR构型为 H3O+ 的分子立体结构为 。
(3)沸点比较:邻羟基苯甲醛 对羟基苯甲醛(填“>”、“<”或“=”)
(4)在下列物质①NH3、②BF3、③HCl、④SO3,属于非极性分子的是(填番号)________。
(5)①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有 (填序号)。
(6)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
(7)配离子[TiCl(H2O)5]2+的中心离子的符号为 ,配位数为 。
X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+3。回答下列问题:
(1)Y是(填名称);(2)写出含有10个中子X原子的原子符号
(3)Z 的最高价氧化物与Z 同主族的单质A能发生置换反应,这个反应在工业上是获得Z 的一步重要反应。写出该反应的化学方程式
(4)W、Y的最高价氧化物对应的水化物相互反应的离子方程式
(5)Y的气态氢化物与氨气反应的生成物溶于水,其溶液显 ____性,其原因是:
(用离子方程式表示)。
用化学用语回答下列问题
(1) 画出磷原子的原子结构示意图:
(2) 写出H2S分子的结构式:
(3) 用电子式表示MgCl2的形成过程:
(4) 写出铜与稀硝酸反应的离子方程式:
(5)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,8.0g N2H4在氧气中完全燃烧生成氮气和液态水,放出热量156 kJ,N2H4完全燃烧反应的热化学方程式是。
(10分)FeCl3是一种重要的化工产品:
(1)电子工业用FeCl3腐蚀铜的原理制造印刷电路板,写出FeCl3与Cu反应的离子方程式:.
(2)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是
;在此基础上,又进行了定量组成的测定:
①取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
②再取50.0 mL待测溶液,向其 中加入过量稀硝酸,得到0.448 L(标准状况下)一种无色气体.写出反应的离子方程式:,待测溶液中c(Cu2+)= mol/L.
中加入过量稀硝酸,得到0.448 L(标准状况下)一种无色气体.写出反应的离子方程式:,待测溶液中c(Cu2+)= mol/L.
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓) 2KCl+2MnCl
2KCl+2MnCl 2+5Cl2↑+8H2O)
2+5Cl2↑+8H2O)
(1)e处反应的离子方程式为_________________________________________。该反应中氧化剂和还原剂的物质的量之比为_______________________。
(2) d处的实验现象:__________________________________________。
(3)c处反应的化学方程式为_________________________________。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为__________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?__________(填“能”或“不能” ),若能,其氧化性由强到弱的顺序是____________________。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白: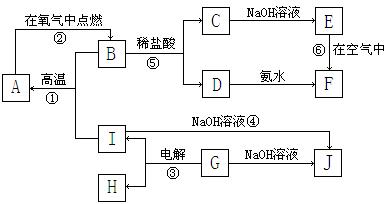
⑴A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置 。
。
⑵写出C、G物质的化学式,C______________ G______________
⑶写出①、④、⑥反应的化学方程式。
反应①
反应④
反应⑥
⑷写出A与水蒸气反应的化学方程式