下图为实验室某浓盐酸试剂瓶标签上的有关数据,
试根据标签上的有关数 据回答下列问题:
(1)该盐酸中HCl的物质的量浓度为 △ mol·L–1
(2)某同学用上述浓盐酸和蒸馏水配制浓度为0.4mol·L–1体积为425 mL的稀盐酸。
①该学生需要取 mL上述浓盐酸进行配制。
②配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 、 。
③上述实验中,需要用到玻璃棒,其作用是 、 。
④在配制过程中,下列操作对配制的稀盐酸的物质的量浓度有何影响(填“偏 大”、“偏小”或“无影响”)
I.用量筒量取浓盐酸时俯视观察凹液面( )
II.定容时仰视刻度线( )
为提高人体素质, 避免人体缺碘影响正常的生命活动,我国早已采取食盐加碘措施。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下图,回答下列问题: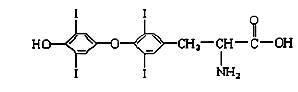
(1)“加碘食盐”中的碘元素以碘酸钾(KIO3 )的形式存在,KIO3中碘的化合价是 ,我们用稀盐酸和淀粉KI试纸可以检验食盐中碘酸钾的存在,反应的离子方程式为 ,实验现象是 。
(2)在“加碘食盐”包装袋上有“烹调时,待食品熟后加入碘盐”文字说明,由此可推测碘酸钾在受热时容易 。
(3)甲状腺素由________种元素组成,碘在人体中属于 (填“常量元素”或“微量元素”)
铝是地壳中含量最高的金属元素,铝及其化合物在生产生活中的应用日趋广泛
(1)铝的原子结构示意图是____________
(2)三氧化二铝是一种两性氧化物,写出其与NaOH溶液反应的化学方程式___________________
(3)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是 。
a.NaOH溶液b.氨水c.CO2d.盐酸
(4)下图表示将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系,最先与CO2发生反应的物质是_________,ab段发生反应的离子方程式为_____________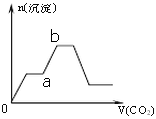
(5)某Mg-Al合金是一种潜在的贮氢材料。73.2 g该合金恰好溶解于1.4 L 5.0 mol·L-1 HCl溶液,则合金中Mg和Al的物质的量之比为 。
A~J均为有机化合物,它们之间的转化如下图所示。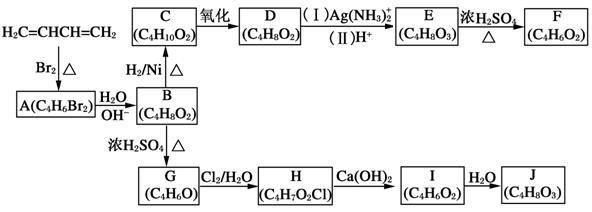
实验表明:
①D既能发生银镜反应,又能与金属钠反应放出氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;[
④I中有两个环状结构;
⑤1 mol J与足量金属钠反应可放出22.4 L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为 (不考虑立体异构),由A生成B的反应类型是 反应;
(2)D的结构简式为 ;
(3)由E生成F的化学方程式为 ,
与E具有相同官能团的E的同分异构体除了 和
和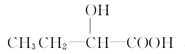 以外,还有 (写出结构简式,不考虑立体异构)。
以外,还有 (写出结构简式,不考虑立体异构)。
(4)G的结构简式为 ;
(5)由I生成J的化学方程式为 。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为 。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填>、<或=)。
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。
写出石墨Ⅰ电极上发生反应的电极反应式 ,
N2O5在电解池的 区生成(填“阳极”或“阴极”)。
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献.生产流程如下图:
(1)完成有关反应的化学方程式
①沉淀池:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置下图模拟“联合制碱法”的第一步反应.

(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验.假设产品纯碱中只含NaCl、NaHCO3杂质.
(5)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32﹣+H+=HCO3﹣反应的终点),所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL.则纯碱样品中NaHCO3质量分数为 .