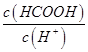我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献.生产流程如下图:

(1)完成有关反应的化学方程式
①沉淀池:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置下图模拟“联合制碱法”的第一步反应.


(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验.假设产品纯碱中只含NaCl、NaHCO3杂质.
(5)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32﹣+H+=HCO3﹣反应的终点),所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL.则纯碱样品中NaHCO3质量分数为 .
图表法、图象法是常用的科学研究方法。
(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:(填“a”或“b”)。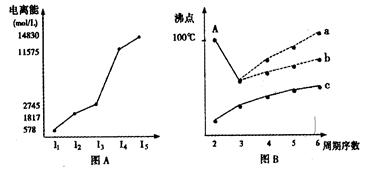
阿立哌唑(A)是一种新的抗精神分裂症药物,可由化合物B、C、D在有机溶剂中通过以下两条路线合成得到。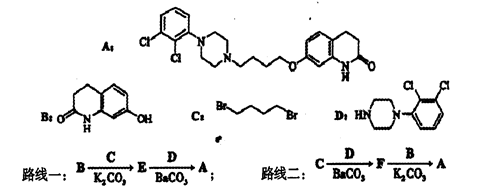
(1)E的结构简式为___________。
(2)由C、D生成化合物F的反应类型是___________。
(3)合成F时还可能生成一种相对分子质量为285的副产物G,G的结构简式为______________。
(4)H属于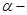 氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式:__________。
氨基酸,与B的水解产物互为同分异构体。H能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式:__________。
(1)写出CO2+离子基态的价电子排布式:__________________________________。
(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。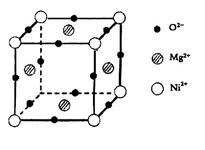
实验室模拟用工业废弃固体(含有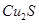 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(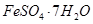 )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下: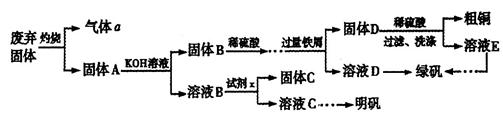
(1)试剂x是_________(写化学式)。
(2)配平下列方程式:
____
(4)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0g样品配成100mL溶液,移取25.00mL用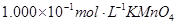 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO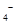 被还原为
被还原为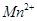 )。
)。
请回答下列问题:
①滴定时,KmnO4标准溶液应盛放在______________(填仪器名称)中。
②若达到滴定终点消耗KmnO4标准溶液体积为25.00mL,则该产品中铁元素的质量分数为_________。
(1)在固定容积为2L的密闭容器中通入NO和CO各2mol发生反应: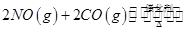
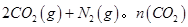 随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题: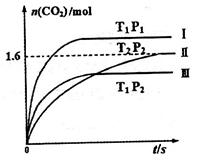
①曲线I、II、III对应反应从开始到平衡时用CO2表示的平均反应速率分别为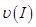 、
、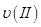 、
、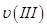 ,则三者大小关系为______________。
,则三者大小关系为______________。
②该反应△H__________0(填“>”、“=”或“<”);曲线II对应平衡常数K=_________;曲线II对应的反应达平衡后,再通入2molNO和2molCO并保持温度不变,则再达平衡时NO的转化率将_______(填“增大”、“减小”或“不变”)。
(2)①25℃时,将0.2mol/L的HCOOH溶液与0.2mol/L的NaOH溶液等体积混合,充分反应后测得溶液pH为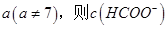 ________
________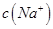 (填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
(填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
②一定温度下,0.2mol/Lr HCOOH溶液加水稀释过程中,下列各项中随着加水量的增加而减小的是____________(填写字母序号)。
a.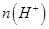 b.
b.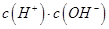 c.
c.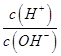 d.
d.