(17分)(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO===Cu+H2O所属的区域。
② “四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中Ⅰ为化合反应,则Ⅱ为 反应。写出有水生成的符合反应类型Ⅲ的一个化学方程式: 。
(2)已知反应:①SO3+H2O===H2SO4
②Cl2+H2O===HCl+HClO
③2F2+2H2O===4HF+O2
④2Na+2H2O===2NaOH+H2↑
⑤2Na2O2+2H2O===4NaOH+O2↑
⑥SiO2+2NaOH===Na2SiO3+H2O
上述反应中不属于氧化还原反应的有 (填序号,下同);H2O被氧化的是 ,H2O被还原的是 ,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是 。
(3)反应2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素的化合价由 价变为 价,被 ; 元素的原子失去电子,被 ;若参加反应的HCl是73 g,则被氧化的HCl是 g。
(4)根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,
②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的( )
| A.Fe3+>Cl2>I2 | B.Cl2>I2>Fe3+ | C.I2>Cl2>Fe3+ | D.Cl2>Fe3+>I2 |
在反应2CuO+C 2Cu+CO2↑中____元素化合价升高______电子,是________剂,被_______,发生_____反应,________元素化合价降低_______电子,是_______剂,被_______,发生________反应。
2Cu+CO2↑中____元素化合价升高______电子,是________剂,被_______,发生_____反应,________元素化合价降低_______电子,是_______剂,被_______,发生________反应。
实验室欲配制100mL 1.4mol/L的NaOH溶液,试回答:
(1)用不到的仪器是:
A烧杯 B500mL容量瓶 C天平 D胶头滴管 E玻璃棒 F100mL容量瓶
(2)配制时应称取NaOH g
(3)实验开始时,需检查容量瓶
(4)下列操作的顺序中还缺少一步操作是什么
计算冷却称量洗涤定容溶解摇匀
(5)若用1.4 mol/L的NaOH溶液润洗容量瓶,实验结果将 。溶解后立刻转移到容量瓶,结果将____________,如果容量瓶洗净后有水结果将_________。
2molSO3和3molSO2其分子数之比为_________;相同状况下(均为气体)体积之比为___________;氧原子数之比为______________。0.2 mol Al2(SO4)3中含有Al3+___________ mol、SO42-__________ mol.
写出下列盐类水解的离子方程式,并指出其溶液的酸碱性。
(1)硫酸铝溶液: (显 性)。
(2)硝酸铵溶液: (显_ 性)。
(3)次氯酸钠溶液: (显_ 性)。
(4)碳酸氢钠溶液: (显_ 性)。
某同学做如下实验,以检验反应中的能量变化。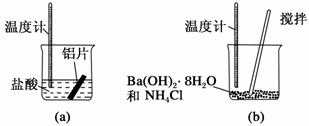
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低,由此可以判断(b)中反应是__________热反应。
(2)根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。