25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
下列判断不正确的是
| A.25 ℃时,该反应的平衡常数K=2.2 |
| B.往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 |
| C.往平衡体系中加入少量金属铅后,c(Pb2+)增大 |
| D.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH < 0 |
2.3g纯净物金属钠在干燥空气中被氧化后得到3.5g固体,由此判断其氧化产物为
| A.Na2O | B.Na2O2 | C.Na2O和Na2O2 | D.无法确定 |
下列离子检验的方法正确的是
| A.某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- |
| B.某溶液中先滴加足量盐酸无规象,再滴加BaCl2溶液有白色沉淀.则原溶液中有SO42- |
| C.某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ |
| D.某溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,说明原溶液中有CO32- |
下列制取单质的反应中,化合物作还原剂的是
A.2C+SiO2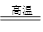 Si+2CO↑ Si+2CO↑ |
B.Zn+H2SO4(稀)=ZnSO4+H2↑ |
| C.Br2+2NaI=I2+2NaBr | D.2Al+Fe2O3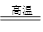 2Fe+Al2O3 2Fe+Al2O3 |
下列反应中,不属于氧化还原反应的是
A.3Fe+4H2O(g) Fe3O4+4H2 Fe3O4+4H2 |
| B.2Na+2H2O=2NaOH+H2↑ |
| C.SnCl4+2H2O=SnO2+4HCl |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
下列说法正确的是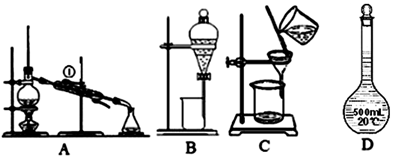
| A.装置A可用于实验室制取蒸馏水,从①处通入冷却水 |
| B.装置B可用于分离苯和水,且苯层由分液漏斗的上口倒出 |
| C.装置C可用于除去固体BaCl2中的MgSO4 |
| D.装置D在配制一定物质的量浓度的溶液之前不能有水 |