氨在国民经济中占有重要地位。
(1)已知合成氨反应:N2(g)+3H2(g) 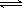 2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是 (填写编号)
2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是 (填写编号)
① 升高温度; ② 缩小容器体积(加压); ③ 选择高效催化剂; ④ 在恒容条件下,再充入合成氨的原料气(N2、H2); ⑤在恒容条件下,再充入原平衡的混合气;⑥在恒容条件下,分离出氨气。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
ΔH(填“>”、“<”或“=”) 0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)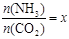 ,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是 。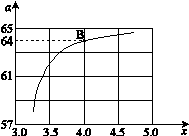
③上图中的B点处,NH3的平衡转化率为 。
已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):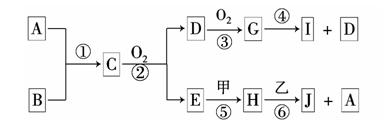
(1)请写出下列物质的化学式C__________、乙_____________;
(2)分别写出反应④⑥的化学方程式__________、________________。
某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,现设计如下综合利用的主要流程。试推断:
(1)方框内物质A和B的化学式:A;B;
(2)第③步通入B的离子方程式为 ___。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3 e -= NO+2H2O
KMnO4、Na2CO3、FeO、Al(OH)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的方程式(不需配平):
______________________________________________________;
(2)反应中,氧化剂是_________,被氧化的元素是_____________;
(3)如反应转移了0.6mol e-,则产生的气体在标准状况下体积为___ L。
人类生活离不开化学,硫酸亚铁、醋酸、小苏打、食盐、次氯酸钙、氢氧化铝都是生活中较常见的化学物质。
(1)医疗上常用_____________(从上述物质中选,填化学式)糖衣片治疗贫血病,外面包裹糖衣的目的是;
(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:____________________、 ___________________________;
(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和,用可以鉴别(填化学专用名词)。
肉桂酸是重要的有机合成中间体,广泛用于医药、香料、塑料和感光树脂等化工产品中。肉桂酸的结构简式为右图,请回答下列问题。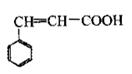
(1)肉桂酸的分子式是。
(2)写出肉桂酸的顺式结构。
(3)肉桂酸与乙醇在一定条件下发生酯化反应的化学方程式是。
(4)已知: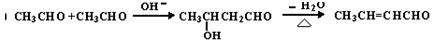
由苯甲醛制备肉桂酸的合成路线如下: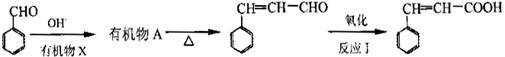
①上述合成路线中,反应I中氧化剂可选择(填写正确选项的字母)。
a.高锰酸钾酸性溶液 b.新制氧氧化铜 c.溴的四氯化碳溶液
②苯甲醛与有机物X反应生成A的化学方程式是