下列溶液里离子检验的结论正确的是
| A.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入足量稀盐酸,溶液无现象,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- |
| D.加入稀盐酸产生无色气体,气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
控制适宜条件,将反应Sn(s)+Pb2+ (aq) Sn2+ (aq)+Pb(s)△H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )
Sn2+ (aq)+Pb(s)△H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )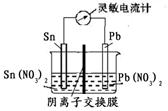
| A.此时化学反应达到平衡状态 |
| B.若此时将Sn电极换成质量较大的Sn 电极后,电流计指针偏转,c(Pb2+)将减小 |
| C.若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极 |
| D.若此时升高温度,c(Sn2+)将减小,Pb电极为负极 |
下列各组离子在指定条件下,能够大量共存的是( )
| A.滴加KSCN溶液后变成血红色的溶液中:K+、SO42―、Mg2+、H+ |
| B.由水电离出的c(H+)=1×10-11mol/L的无色溶液中:Al3+、Cu2+、NO3―、SO42― |
| C.能使淀粉KI试纸变蓝的无色溶液中:Na+、S2―、K+、Br― |
| D.能使蓝色石蕊试纸变红的溶液中:K+、Na+、AlO2―、HCO3― |
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
| A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向纯水中加人少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变 |
已知可逆反应:M(g)+N(g) P(g)+Q(g)△H>0 。反应达到平衡后,若要增大M的转化率,在其它条件不变的情况下可以采取的措施为( )
P(g)+Q(g)△H>0 。反应达到平衡后,若要增大M的转化率,在其它条件不变的情况下可以采取的措施为( )
①加入一定量的M②加入一定量的N③升高反应体系的温度④缩小容器体积
⑤加入某物质作催化剂⑥分离出一定量的P
| A.①③⑤ | B.②④⑥ | C.②③⑥ | D.④⑤⑥ |
在10mL pH=12的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是( )
| A.0.01mol/L CH3COOH | B.0.01mol/L HNO3 |
| C.pH=2的H2SO4溶液 | D.pH=2的CH3COOH溶液 |