由相同条件下的三个反应:①2NaA +B2 ="2NaB" +A2; ②2NaC +A2 ="2NaA" +C2;
③2NaB +D2 ="2NaD" +B2;可判断
| A.氧化性:A2>B2>C2>D2 |
| B.还原性:C->A->B->D- |
| C.2NaD +A2 ="2NaA" +D2可进行 |
| D.2NaC+B2 =2NaB+C2不能进行 |
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此原理有关的是
①乙醇易挥发②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧化合物
| A.①③ | B.②③ | C.②④ | D.①④ |
下列各组物质的关系描述正确的是
| A.H2O与D2O属同系物 |
| B.35Cl与37Cl属同素异形体 |
| C.O2与O3属同位素 |
| D.乙醇与二甲醚(CH3-O-CH3)属同分异构体 |
在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是
| A.制半导体的材料 | B.耐高温、耐腐蚀的合金材料 |
| C.制农药的材料 | D.制催化剂的材料 |
19世纪中叶,俄国化学家门捷列夫
| A.提出了原子分子学说 | B.提出了元素周期律 |
| C.制出了第一张元素周期表 | D.发现了质量守恒定律 |
硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如右图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )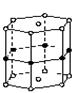
| A.MgB | B.Mg3B2 |
| C.MgB2 | D.Mg2B3 |