常温下,某一元弱酸的电离平衡常数为:Ka=10-6,对于0.01mol·L-1的该酸,下列说法不正确是
| A.该弱酸溶液的pH=4 |
| B.加入NaOH溶液后,弱酸的电离平衡向右移动,但Ka不变。 |
| C.加入等体积的0.01mol·L-1NaOH溶液后,所得的溶液的pH<7 |
| D.该弱酸的钠盐溶液一定会发生水解,常温下,其水解平衡常数Kh=10-8 |
一定量的Fe和Fe2O3混合物投入250ml 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标况),再向反应后溶液中加入1 mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
| A.450ml | B.500ml | C.400ml | D.无法确定 |
有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl—、SO42—、HCO3—、MnO4—中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
| A.肯定有A13+、Mg2+、NH4+、Cl— | B.肯定有A13+、Mg2+、SO42— |
| C.肯定有K+、HCO3—、MnO4— | D.肯定有A13+、Mg2+、HCO 3— 3— |
下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:CO32-、Na+、 AlO2-、NO3-
AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、 Cl-
Cl-
| A.①② | B.③⑥ | C.③⑤ | D.②④ |
反应L(s)+aG(g)  bR(g)达平衡时,温度和压强对该反应的影响如图所示。图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达平衡时,温度和压强对该反应的影响如图所示。图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断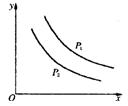
| A.上述反应是放热反应 |
| B.上述反应是吸热反应 |
| C.a>b |
| D.无法判断a、b的相对大小 |
下列物质性质的变化规律与分子间作用力有关的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.金刚石的硬度大于硅,其熔、沸点也高于硅 |
| C.NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D.F2、Cl2、Br2、I2的熔、沸点逐渐升高 |