通过海水晾晒可得粗盐。粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示。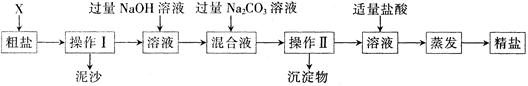
根据以上信息回答:
(1)在完成操作Ⅰ之前,必须加入的X物质是 。
(2)操作Ⅰ和操作Ⅱ的名称是 。该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 (填序号)。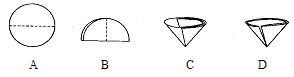
(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取 等措施。
(4)在实验过程中加入过量的NaOH溶液,其实验目的是 。
(5)判断加入的盐酸“适量”的方法是 。
(6)实验所得精盐的质量_________(填“大于”、“小于”或“等于”)粗盐中NaCl的质量,原因是 。
有可逆反应A(g)+B(g)  2C(g),在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。填写下列空白:
2C(g),在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。填写下列空白:
⑴反应在温度下达到平衡。⑵正反应为热反应(填“放”或“吸”)。⑶由T3向T4变化时,v正v逆(填“>”、“<”或“=”)。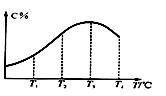
中学常用淡黄色的pH试纸测定溶液的酸碱性。在25℃时,若溶液的pH=7,试纸不变色;若pH< 7 ,试纸变红色;若pH > 7,试纸变蓝色。
⑴已知水中存在如下平衡: H2O + H2O 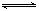 H3O+ + OH-。现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是
H3O+ + OH-。现要使平衡向右移动,且所得的溶液呈酸性,选择的方法是
| A.向水中加入NaHSO4 | B.向水中加入Cu(NO3)2 | C.加热至100℃ | D.向水中加入(NH4)2SO4 |
⑵现要用pH试纸测定100℃沸水的pH。若则试纸显色,溶液呈性(填酸、碱或中)。
⑶纯碱因水溶液显碱性而得名。请用离子方程式表示显碱性的原因:
。
在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
①生成SO3mol;②O2的转化率为;
③平衡时容器内气体总物质的量为mol;
④平衡时体系中SO3的百 分含量(体积分数)为;
⑤若反应前容器内压强为p1,则平衡时容器内的压强为(用p1表示)
重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
请回答下列问题。
⑴铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为▲。
⑵若Ⅰ中只用一种试剂调节溶液的pH,应选用▲(填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
⑶Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:
▲。(用离子方程式表示)。
⑷Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应▲(填“是”或“不是”)氧化还原反应。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液▲ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是▲。
钨是高熔点金属,工业上用黑钨铁矿[(Fe,Mn)WO4]冶炼金属钨有多种方法,同时还可制得副产品高锰酸钾。已知WO3是钨的稳定氧化物,它不溶于水也不溶于酸,可用钨酸(H2WO4,黄色,不溶于水)或某些钨酸盐分解制得。其主要的工艺流程如下: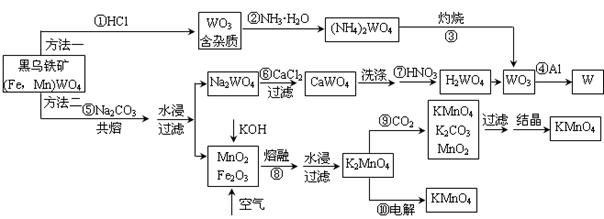
请根据图示及所学知识回答下列问题:
⑴写出反应④的化学方程式:▲。
⑵写出反应⑨的离子方程式:▲。
⑶方法二制WO3的过程中,需洗涤CaWO4,如何检验CaWO4已洗涤干净:▲。
⑷整个工艺流程所涉及的物质中,属于酸性氧化物的有▲。
⑸写出反应⑩中阳极反应的电极反应式:▲。