设NA为阿伏加德罗常数的值,下列叙述正确的
| A.50 mL 12 mol•L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| B.5.6 g 铁与0.1 mol 氯气充分反应转移电子数为0.3NA |
| C.1L1mol·L-1NaClO 溶液中含有ClO-的数目为NA |
| D.60gSiO2晶体中含有硅氧键的数目为4 NA |
某化学学习小组学习电化学后,设计了下面的实验装置图: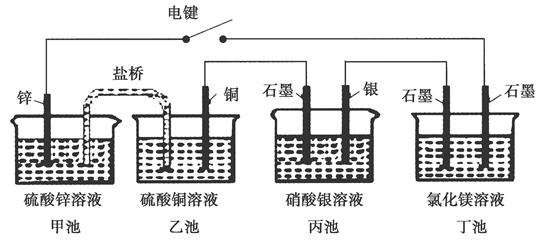
下列有关该装置图的说法中正确的是( )
| A.合上电键后,盐桥中的阳离子向甲池移动 |
| B.合上电键后,丙池为电镀银的电镀池 |
| C.合上电键后一段时间,丙池中溶液的pH增大 |
| D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体 |
目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠溶液为电解质,电池放电时的总反应为2Zn+O2=2ZnO,下列判断正确的是( )
| A.放电时,OH-向负极方向移动 |
| B.放电时,正极反应式为Zn+2OH--2e-=ZnO+H2O |
| C.充电时,Zn发生氧化反应 |
| D.充电时,阴极反应为O2+2H2O+4e-=4OH- |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )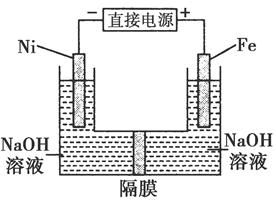
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+8H+ |
| B.镍电极上的电极反应为2H++2e-=H2↑ |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
“神舟九号”与“天宫一号”成功对接,是我国载人航天事业发展走向成熟的一个标志。空间实验室“天宫一号”的供电系统为再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图,下列有关说法正确的是( )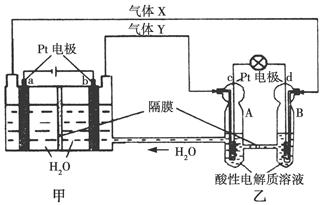
A.图甲把化学能转化为电能,图乙把电能转化为化学能,水得到了循环使用
B.当有0.1 mol电子转移时,a极产生0.56 L O2(标准状况下)
C.c极上发生的电极反应是O2+4H++4e-=2H2O
D.图乙中电子从c极流向d极,提供电能
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A.充电时阳极反应为Zn-2e-+2OH-=Zn(OH)2 |
| B.充电时OH-向阳极移动 |
| C.放电时每转移3 mol e-正极有1 mol K2FeO4被氧化 |
| D.充电时,电源的正极应与电池的Zn(OH)2极相连 |