存在于茶叶的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种。A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下图: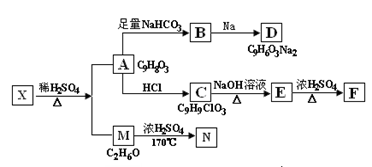
请回答下列问题:(1)有机物A中含氧官能团的名称是 ;
(2)写出下列反应的化学方程式
A→B: ;
M→N: ;
(3)A→C的反应类型为 ,E→F的反应类型为 ;
(4)1mol A可以和 mol Br2 反应;
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有 种(不包括R);
(6)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方程式
有关FeSO4的转化关系如下图所示(无关物质已略去)。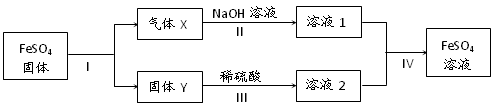
已知:① X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,
产生白色沉淀。② Y是红棕色的化合物。
(1)气体X的成分是(填化学式)。
(2)反应I的反应类型属于(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是。
(4)若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L NaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是。
铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是。
(2)某实验小组利用下图装置验证铁与水蒸气的反应。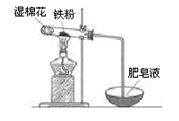
①湿棉花的作用是,试管中反应的化学方程式是。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,
固体完全溶解,所得溶液中存在的阳离子是_____(填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。经测定气体中含有SO2、CO2和H2。
①铁与浓硫酸反应的化学方程式是。
②气体中混有CO2的原因是(用化学方程式表示)。
③将672 mL(标准状况)收集到的气体通入足量溴水中,反应的离子方程式为,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66 g。由此推知收集到的气体中SO2的体积分数是。
铜是重要的金属材料.
(1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为,该反应中氧化剂为________.
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<________mol.
(3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程.
上述流程中,所加试剂的化学式为:
X________________,Y____________,Z____________;
第⑥步反应的离子方程式为___________________________
现有A、B、C、D、E、F六种物质,已知它们的阳离子有:H+、K+、NH4+、Ca2+、Ba2+、Al3+,阴离子有:OH-、Cl-、ClO-、NO3-、CO32-、SO42-。将上述六种物质溶于水均配成0.1mol/L溶液,进行如下实验。
①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C。
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失。
③向F中加入A有无色气体生成。
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体。
(1)根据以上信息,填写下列溶液中溶质的化学式 C ________ E ________
(2)书写D与过量的E反应的离子方程式。
(3)书写实验④中反应的离子方程式。
(4)向100mLA溶液中慢慢滴加入75mLF溶液和向75mLF溶液中慢慢滴加入100mLA溶液产生的气体体积之比约为____________。
已知A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大。A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB3两种分子。请回答下列问题:
(1)元素E在元素周期表中的位置是,A、B、C、D、E五种元素原子半径由小到大的顺序为(用元素符号书写)。
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是。
(3)在上述元素最高价氧化物对应的水化物中酸性最强的是(写化学式,下同),非金属气态氢化物还原性最强的是。
(4)A、B、C、D中的三种或四种元素能形成多种离子化合物,其中水溶液呈酸性的有(写出所有化合物,用化学式表示,下同),能与稀盐酸发生氧化还原反应的有。