I、水的电离平衡曲线如图1所示:
(1)若以A点表示在25℃时水电离平衡时的离子浓度,当温度升高到100℃时,水的电离平衡状态到达B点,则此时水的离子积从_________增加到__________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持25℃的恒温,致使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
II、物质A~D为CH3COOH、NaOH、HCl、NH3·H2O中的各一种,常温下将各物质的溶液从1 mL稀释到1000mL ,PH的变化关系如图2所示。请回答下列问题:
根据PH的变化关系,写出物质的化学式:B ,C 。
(2)写出A与C反应的离子方程式:
(3)将含等物质的量B和D的两溶液充分混合后,溶液呈现 性(填“酸”、“碱”或“中”),加热该溶液,则该溶液的PH (填“增大”“减小”或“不变”)。
已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是___________,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为_________________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH)__________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显价,A的电负性B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),已知3种离子晶体的晶格能数据如下表: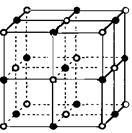
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。
(5)某配合物的分子结构如右图所示,其分子内不含有 (填序号)。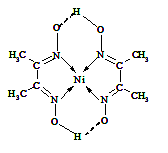
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质。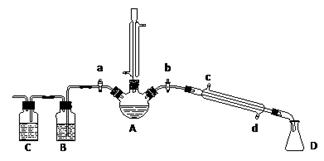
(一)溴乙烷的制备及产物的检验:设计了如上图装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:
(1)仪器A的名称是
(2)制备操作中,加入的少量的水,其目的是。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(3)加热片刻后,A中的混合物出现橙红色,该橙红色物质可能是____________
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等
① 检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是、
② 检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚。请你对该同学的观点进行评价:
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用右图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(1)观察到___________现象时,表明溴乙烷与NaOH溶液已完全反应。
(2)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是,若无A试管,B试管中的试剂应为。
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH) 、Pb(OH)
、Pb(OH)  ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示: 
(1)Pb(NO3)2溶液中, ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离 子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
| 处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
| 处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________。
(4)如果该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+ E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )
A.4~5B.6~7 C.9~10D.11~12
有甲、乙、丙三种物质: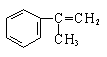


甲乙丙
(1)乙中含有的官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):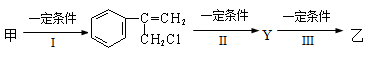
其中反应I的反应类型是_________,反应II的条件是_______________,反应III的化学方程式为__________________________________(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下:
(a)下列物质不能与B反应的是(选填序号)。
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
(b)C的结构简式为___________;丙的结构简式为。
(c)D符合下列条件的所有同分异构体种,任写其中一种能同时满足下列条件的异构体结构简式。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应