将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。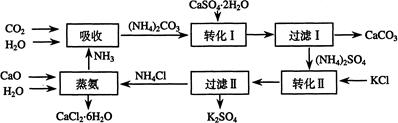
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:____________ 。
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) |
0 |
20 |
60 |
| K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是
a、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题: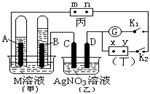
(1)M溶液可能是(填序号)。
A.KNO3溶液 B. Ba(OH)2溶液 C.H2SO4溶液 D. NaCl溶液 E.CuSO4溶液
(2)C极的电极反应式为。
(3)滤纸丙的m端发生的现象为。
煤燃烧的反应热可通过两个途径来利用:a.利用煤在充足空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳。然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的化学方程式为:
a. C(s)+ O2(g) = CO2(g)△H=E1①
b. C(s) + H2O(g) = CO(g)+ H2(g)△H=E2②
H2(g)+ 1/2 O2(g) = H2O(g)△H=E3③
CO(g)+ 1/2 O2(g) = CO2(g)△H=E4④
回答:⑴与途径a相比途径b有较多的优点,即。
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A、a比b多B、a比b少C、a与b在理论上相同
(3)根据能量守恒定律,E1、E2、E3、E4之间的关系为_
采用惰性电极从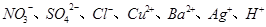 中选出适当离子组成的电解质(非熔融态下),并电解,
中选出适当离子组成的电解质(非熔融态下),并电解,
(1)若阴极析出金属,阳极放出O2,电解质所有可能为。
(2)若两极分别放出气体,且体积比为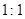 ,电解质所有可能为。
,电解质所有可能为。
按要求对下图中两极进行必要的联接并填空:
(1)在A图中,使铜片上冒H2气泡。请加以必要联接,则联接后的装置叫。电极反应式:
锌板:;铜板:。
(2)在B图中,a和 b都是石墨电极,使a极析出铜,则b析出:。加以必要的联接后,电极反应式,a极:b极:。经过一段时间后,停止反应后加入一定量的,溶液能恢复至与电解前完全一致。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
(1)关于该反应的下列说法中,正确的是_______。
| A.△H>0,△S>0; | B.△H>0,△S<0; | C.△H<0,△S<0; | D.△H<0,△S>0。 |
(2)该图中能量的最高点和最低点之间的差值代表
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) _________mol·L-1·min-1。