下列各组物质的分类正确的是
①混合物:水玻璃、水银、水煤气 ②电解质:明矾、冰醋酸、胆矾 ③酸性氧化物:CO2、CO、SO3
④同位素:1H、2H2O、3H ⑤同素异形体:C80、金刚石、石墨 ⑥干冰、液氯都是非电解质
| A.①②③④⑤⑥ | B.②④⑤⑥ | C.②⑤⑥ | D.②⑤ |
设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,46g NO2中含有氧原子个数为2NA |
| B.在标准状况下,22.4 L丙烷中所含C—H键数目为6NA |
| C.将58.5g NaCl溶于1 L水中,溶液中所含Na+和Cl-总数为2NA |
| D.以二氧化锰和浓盐酸为原料制备氯气,当生成1mol氯气,电子转移总数为4NA |
类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列各说法中正确的是
| A.根据化合价Fe3O4可表示为FeO·Fe2O3,则Fe3I8也可表示为FeI2·2FeI3 |
| B.CaC2能水解:CaC2+2H2O→Ca(OH)2 + C2H2↑ , 则Al4C3也能水解:Al4C3 + 12H2O→4Al(OH)3↓+ 3CH4↑ |
| C.O2与Cu反应加热生成CuO,则S与Cu反应加热生成CuS |
| D.SO2通入BaCl2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀 |
25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数为
| A.12.5% | B.25% | C.50% | D.75% |
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种: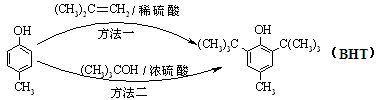
下列说法错误的是
A.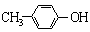 能与Na2CO3溶液反应 能与Na2CO3溶液反应 |
B. 与BHT互为同系物 与BHT互为同系物 |
| C.BHT久置于空气中会被氧化 |
| D.两种方法的反应类型都是加成反应 |
下列实验操作与预期实验目的或实验结论不一致的是
| 选项 |
实验操作及现象 |
实验目的或结论 |
| A |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
可证明氧化性H2O2比Fe3+强 |
| B |
在0.1 mol/L的NaHCO3溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 |
验证盐类水解反应是吸热反应 |
| C |
铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净 |
除去铁屑表面的油污 |
| D |
苯酚钠溶液中通入足量二氧化碳产生浑浊 |
苯酚的酸性弱于碳酸 |