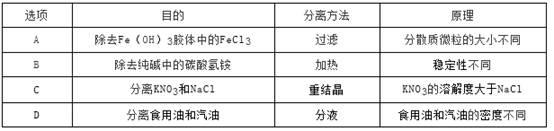
利用下图所示实验装置测定气体摩尔体积,所用药品为1g锌粒和10 mL 0.5 mol·L-1硫酸溶液,相关叙述正确的是
| A.实验时,将硫酸溶液倾斜倒入锌粒中 |
| B.实验时,量气管压入漏斗的水过多而溢出,不影响实验 |
| C.实验时,待体系温度降低到0℃时方可进行读数 |
| D.实验时,用CCl4代替水,测得氢气的体积更准确 |
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是
| A.参加反应的硝酸是0.4mol | B.混合气体中含NO21. 12 L |
| C.此反应过程中转移的电子为0.3 mol | D.消耗氧气的体积为1.68 L |
某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)
| A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O |
B.该消毒液的pH约为12:ClO-+H2O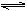 HClO+OH- HClO+OH- |
| C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-=Cl2↑+H2O |
| D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- |
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g)ΔH=" x" kJ·mol-1
已知碳的燃烧热ΔH1=" a" kJ·mol-1 S(s)+2K(s)==K2S(s)ΔH2=" b" kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s)ΔH3=" c" kJ·mol-1 则x为
| A.3a+b-c | B.c-3a-b | C.a+b-c | D.c-a-b |
下列实验中,所采取的分离方法与对应原理都正确的是