由短周期元素组成的中学常见物质A、B、C、D、E存在右图转化关系(部分生成物和反应条件略)。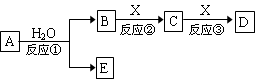
(1)若反应①在常温下进行,且E有漂白、杀菌作用,C是造成温室效应的主要气体,则:
E的电离方程式为 ,反应③的离子反应方程式为 。
(2)若反应①是重要的工业反应之一, X是生产生活中使用最广泛的金属,则:
a.若B为气体单质,反应①的化学反应方程式为 。
b.若E为非金属氧化物,C的化学式为 。
(3)若A分子含有4个碳原子,D、E是同种有机物,75% B的水溶液常用于医疗消毒,则:反应①的化学反应方程式为 。
(4)若A由两种元素构成,B为气体,E为白色沉淀,B、E都能使酚酞试液变红,则:反应①的化学反应方程式为 。
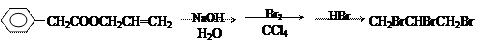
(1)写出以上有机物转化过程中各步反应的化学方程式
第一步:
第二步:
第三步:
(2)写出CH2BrCHBrCH2Br的所有同分异构体的结构简式
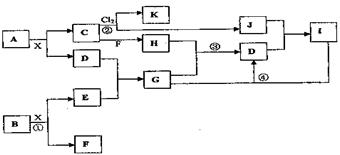
请按要求回答:
(1)写出A的化学式H的电子式
(2)反应①中每生成l mol F,转移电子的物质的量为
(3)反应②进行的条件为
(4)反应③的化学方程式为
(5)反应④的离子方程式为
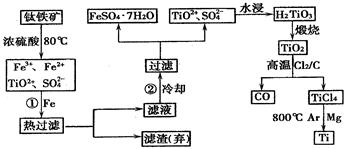
(1) Fe的原子序数为26,Fe位于元素周期表中第周期,第族
(2) 步骤①加铁粉的目的是
步骤②冷却的目的是
(3) 上述过程中,可以利用的副产物是
(4) 写出TiO2、Cl2、C在高温下发生反应的化学方程式
(5) 反应TiCl4+2Mg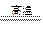 2MgCl2+Ti ,在Ar气体中进行的目的是
2MgCl2+Ti ,在Ar气体中进行的目的是
常温常压下,A、B、C、D均为气体。A与B可发生可逆反应:A+B C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
| 温度/℃ |
压强/Pa |
C平衡浓度/mol·L-1 |
| 25 |
1×105 |
1.0 |
| 25 |
2×105 |
1.8 |
| 25 |
3×105 |
3.2 |
| 25 |
4×105 |
6.0 |
(1)该可逆反应中化学计量数n的取值范围为__________,理由是______________。
(2)在5×105 Pa时,D的状态为______________。
在763 K和3.04×104kPa时,用CO与H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)设起始时,n(H2)∶n(CO)=m,平衡时CO转化率为α,CH3OH的体积分数为y,则m、α、y三者的关系是___________。
(2)将下表已知数据代入上述关系,进行计算,将结果填入表中:
| m |
α |
y |
| 1 |
0.25 |
① |
| 2 |
0.45 |
② |
| 3 |
③ |
19.35% |
(3)根据表中数据,可得出最佳反应物的配比m是_________,原因是______________。