在763 K和3.04×104kPa时,用CO与H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)设起始时,n(H2)∶n(CO)=m,平衡时CO转化率为α,CH3OH的体积分数为y,则m、α、y三者的关系是___________。
(2)将下表已知数据代入上述关系,进行计算,将结果填入表中:
| m |
α |
y |
| 1 |
0.25 |
① |
| 2 |
0.45 |
② |
| 3 |
③ |
19.35% |
(3)根据表中数据,可得出最佳反应物的配比m是_________,原因是______________。
V2O5是接触法制硫酸的重要催化剂,工业上生产V2O5的工艺流程如下:请回答下列问题: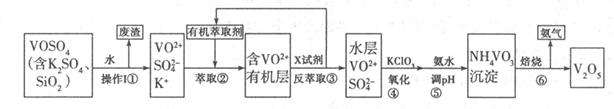
(1)步骤①所得废渣的成分是(写化学式),它与NaOH溶液反应的离子反应方程式为。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是。
②中萃取时必须加入适量碱,其原因是。
(3)步骤③中X试剂为,步骤④的目的是,步骤⑤的离子方程式为。
(4)该工艺流程中,可以循环利用的物质有和。
镁、铝、铁及其化合物在生产、生活中有着广泛的应用
I:实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: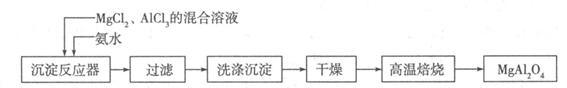
(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,该温度下向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成沉淀(填化学式)。
(2)高温焙烧时发生反应的化学方程式,洗涤沉淀时的方法是。
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:。
Ⅱ:某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。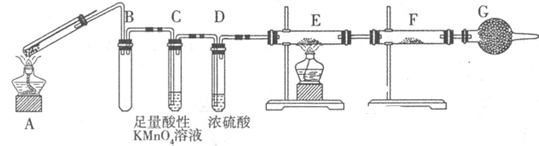
(1)G装置的作用是 。
(2)证明有SO2生成的现象是,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 、 。
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是。
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、l8%
I.(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)  2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的最佳途径是使用高效催化剂 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的常用方法是升高温度 |
(2)还可以用活性炭还原法处理氮氧化物,反应为:C(s)+2NO(g)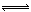 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.050 |
0.025 |
0.025 |
| 30 |
0.050 |
0.025 |
0.025 |
| 40 |
0.036 |
0.032 |
0.010 |
| 50 |
0.036 |
0.032 |
0.010 |
①T1℃时,该反应的平衡常数K= (保留两位小数)。
⑦前10min内用v(NO)表示的化学反应速率为,30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:l,则该反应的a 0(填“>”、“=”或“<”)。
Ⅱ.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知相关反应过程的能量变化如图所示
则用SO2除去CO的热化学方程式为。
(2)高温时,也可以用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此反应的化学方程式是。
②由Mg可制成“镁一次氯酸盐”电池,其装置示意图如图,则镁电极发生的电极反应式为 ,该电池总反应的离子方程式为。
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是。
(2)验证炉渣中含有FeO必要的化学试剂为。
(3)已知:生成氢氧化物沉淀的pH
| 物质 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀时 |
1.5 |
3.4 |
6.3 |
| 完全沉淀时 |
2.8 |
4.7 |
8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是。
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1
2SO2(g)+ O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_______(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是。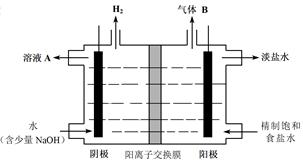
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是。
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是。