工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1
2SO2(g)+ O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_______(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是 。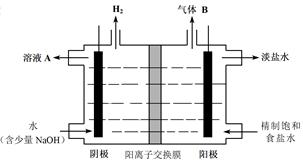
②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 。
(8分)用化学方程式或电离方程式解释下列有关实验现象:
(1)取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有“白霜”。
(2)向氨水中滴几滴酚酞试液,溶液变红色:
(3)一瓶无色气体打开瓶盖后,瓶口呈现出红棕色:
(本小题满分10分)已知A 是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。已知B、D是厨房常用调味剂。
请回答下列问题:
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)物质A可以被直接氧化为D,其化学方程式可表示为。
(4)写出下列反应的化学方程式
②;
④。
(本小题满分7分)
(1)衣服上沾有动、植物油污,用水洗不掉,但可用汽油洗去,这是因为大多数有机物难而易。有机化工厂附近严禁火种,这是因为绝大多数有机物。
(2)为了检验和除去下表中的各种物质中的杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(II)中选出适当的除杂试剂,将所选的答案填入相应的空格内。
| 物质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
||
| 酒精(水) |
(I)检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶液C.盐酸D.氢氧化钠溶液
(II)除杂试剂:a. 无水硫酸铜 b.氢氧化钠溶液 c.新制的生石灰d.溴水
(本小题满分16分)
Ⅰ.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是
(3)控制城市空气污染源的方法可以有(多选扣分)
a.开发氢能源 b.使用电动车 c.植树造林 d.戴上呼吸面具
Ⅱ.A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图, B的最外层电子数比K层电子多1,
B的最外层电子数比K层电子多1,
D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
(1) 指出元素A在周期表中的位置,其气态氢化物的化学式为。
(2) D和E两种元素相比较,非金属性较强的是(填元素符号),
可以验证该结论的是(填写字母序号);
A.比较这两种元素的常见单质的熔沸点 B.比较这两种元素的气态氢化物的熔沸点
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素置换能力的强弱
(3)C、D、E三种元素最高价氧化物的水化物的酸性由强到弱的顺序:。(填写化学式)
有下列晶体:①冰②金刚石③氩④过氧化钠⑤二氧化硅⑥氯化镁⑦纯醋酸⑧白磷⑨氯化铵⑩金属铝。用序号回答下列问题:
(1)在一定条件下能导电而不发生化学变化的是;
(2)只含有极性共价键的分子晶体是 ;
(3)固态时,晶体中只含有范德华力的是;
(4)含共价键的离子晶体是 ;
(5)只含有离子键的离子晶体是_______;
(6)只含有非极性键的原子晶体是_________;